题目内容
【题目】有下列电解质①氯化铵;②氯化氢;③硫化氢;④碳酸氢钠;⑤磷酸;⑥一水合氨。
(1)属于强电解质的有______;
(2)属于弱电解质的有______。
【答案】①②④ ③⑤⑥
【解析】
电解质的强弱是根据在水中电离程度划分的,在水溶液里完全电离的电解质是强电解质,仅有一部分电离的电解质是弱电解质,强酸、强碱和大部分的盐属于强电解质。
①氯化铵属于盐,在水溶液中能完全电离,属于强电解质;
②氯化氢是强酸,在水溶液中完全电离成氢离子和氯离子,属于强电解质;
③氢硫酸为二元弱酸,在水溶液中电离分步进行,电离方程式为H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-,属于弱电解质;
H++S2-,属于弱电解质;
④碳酸氢钠属于盐,在水溶液中电离出钠离子和碳酸氢根离子,属于强电解质;
⑤磷酸是三元弱酸,在水溶液中分步电离,以第一步为主,H3PO4![]() H++H2PO4-,属于弱电解质;
H++H2PO4-,属于弱电解质;
⑥一水合氨在水中只能够部分电离,存在电离平衡,电离方程式为:NH3·H2O![]() NH4++OH-,属于弱电解质;
NH4++OH-,属于弱电解质;
综上所述可知:属于强电解质的为①②④;属于弱电解质的为③⑤⑥。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案【题目】800℃时,可逆反应 CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数 K=1,800℃时,测得某一时刻密闭容器中各组分的浓度如表,下列说法正确的是( )
物质 | CO | H2O | CO2 | H2 |
浓度/molL-1 | 0.002 | 0.003 | 0.0025 | 0.0025 |
A.此时平衡逆向移动
B.达到平衡后,气体压强降低
C.若将容器的容积压缩为原来的一半,平衡可能会向正向移动
D.正反应速率逐渐减小,不变时,达到化学平衡状态
【题目】下图为元素周期表的一部分,根据元素a~j在周期表中的位置,按要求回答下列问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | a | |||||||
2 | b | c | d | e | ||||
3 | f | g | h | i | j | |||
(1)f、g、h的单质分别与水反应,最剧烈的是___________(填元素符号)。
(2)c、i的氢化物稳定性较强的是____________(填化学式)。
(3)c、f可形成既含离子键又含非极性键的化合物,该化合物的电子式为__________。
(4)d、f、g的离子半径最大的是_______________(填离子符号)。
(5)f的最高价氧化物的水化物与h的最高价氧化物的水化物反应的离子方程式为:_______
【题目】铁是人体必需元素,是合成血红素的重要原料,缺铁会造成贫血,市场上常见补血剂有硫酸亚铁、富马酸亚铁(分子式C4H2O4Fe)、葡萄糖酸亚铁、琥珀酸亚铁(速力菲片)等。某化学兴趣小组通过实验对硫酸亚铁补血剂成分进行探究并测定Fe2+的含量,可供选择的试剂有双氧水、KSCN溶液、盐酸、BaCl2溶液(已知KSCN可被双氧水氧化)。
(1)成分探究:小组成员发现硫酸亚铁补血剂外面糖衣是红色的,里面是淡蓝绿色的,甲同学对其组成进行如下探究:
实验探究 | 实验操作及现象 | 结论分析 |
探究一 | 将淡蓝绿色粉末溶解于盐酸溶液中,取上清液2份, ①1份滴加BaCl2溶液,产生白色沉淀,再加盐酸,无明显变化。 ②另1份溶液先滴加KSCN溶液,无明显变化,再滴加双氧水,后滴加___溶液,变成血红色。 | 证明淡蓝绿色粉末为FeSO4 |
探究二 | 将红色物质研成粉末,滴加盐酸,无明显变化,再滴加KSCN溶液,无明显现象。 | 证明:红色物质不是Fe2O3 |
(2)配制硫酸亚铁补血剂的待测溶液。
①补血剂(1片0.5克)![]() 浊液
浊液![]() 滤液
滤液![]() 配成1L待测液
配成1L待测液
步骤③浊液脱色后进行___(填标号)操作才能得到溶液。
A. B.
B.
C. D.
D.
②甲同学认为步骤③滤液直接蒸发结晶不能得到硫酸亚铁晶体,理由是___,你的方案是___。
③已知步骤④中加入足量的H2O2溶液,作用是___,然后微热并用玻璃棒搅拌至无气泡产生,目的是___。
④写出步骤④中发生反应的离子方程式:___。
(3)测定硫酸亚铁补血剂待测液的浓度
方法一:用紫外分光光度法:使用紫外分光光度计,将不同波长的光连续地照射到一定标准浓度滴加5mL0.2molL-1苯二甲酸氢钾缓冲液的硫酸亚铁标准溶液,得到与不同波长相对应的吸收强度,以硫酸亚铁标准溶液的浓度为横坐标,吸光度为纵坐标,绘出该物质的吸收光谱曲线如图。
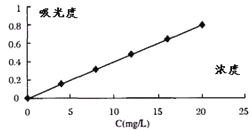
⑤取待测液10mL滴加5mL0.2molL-1苯二甲酸氢钾缓冲液,并稀释至60mL,用紫外分光光度法测得待测液的吸光度为0.4,则样品中铁元素的质量分数是___。
方法二:KMnO4标准溶液滴定法:称取4.0g的硫酸亚铁产品,溶于水,加入适量稀硫酸,用0.2molL-1KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积10.00mL。
⑥KMnO4溶液置于___式滴定管中,终点的颜色变化:___。
⑦要达到好的治疗效果,服用补血剂时需注意口服铁剂应同时并服维生素C,理由是 ___。
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) ___________。
③向NaCN溶液通入少量CO2反应的化学方程式是_____________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____________;此时c(HCN)/c(CN-)=____________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是___________________________。
(3)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol·L-1 Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_____________mol·L-1。
