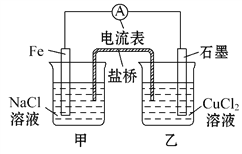
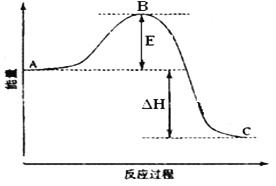
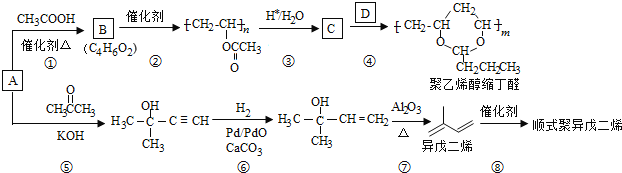
题目内容
【题目】800℃时,可逆反应 CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数 K=1,800℃时,测得某一时刻密闭容器中各组分的浓度如表,下列说法正确的是( )
物质 | CO | H2O | CO2 | H2 |
浓度/molL-1 | 0.002 | 0.003 | 0.0025 | 0.0025 |
A.此时平衡逆向移动
B.达到平衡后,气体压强降低
C.若将容器的容积压缩为原来的一半,平衡可能会向正向移动
D.正反应速率逐渐减小,不变时,达到化学平衡状态
【答案】A
【解析】
A、Qc=![]() =1.04>K,所以平衡逆向移动,故A正确;
=1.04>K,所以平衡逆向移动,故A正确;
B、反应前后气体分子数不变,体系压强不变,所以达到平衡后,气体压强不变,故B错误;
C、若将容器的容积压缩为原来的一半,相当于加压,但加压不对化学平衡产生影响,故C错误;
D、反应逆向进行,说明v逆>v正,随着反应进行,CO和H2O的浓度增大,正反应速率增大,故D错误,
故选:A。

 阅读快车系列答案
阅读快车系列答案【题目】(1)葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
①写出上述氧化还原反应的化学方程式:___________________
②若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积________(填序号)。
A.=10 mL B.=40 mL C. <10 mL D. >40 mL。
③若滴定终点时PH=8.8,可选择_______为指示剂
④滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)__________________________
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)