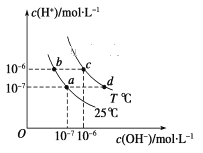
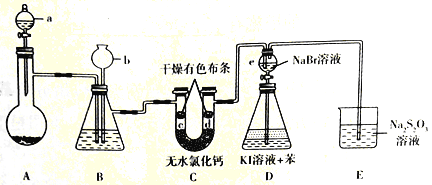
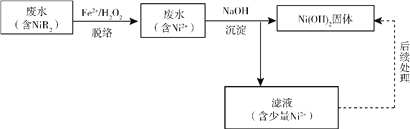
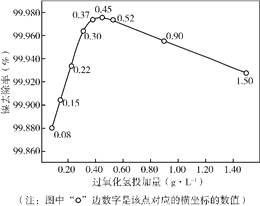
��Ŀ����
����Ŀ����ѧ����Ƴ�����ĤH2Sȼ�ϵ�أ�ʵ��������H2S������Դ�����������õ�����������ĤH2Sȼ�ϵ�صĽṹʾ��ͼ����ͼ��ʾ������˵������ȷ����

A. �缫aΪ��صĸ���
B. �缫b�Ϸ����ĵ缫��ӦΪ��O2 +4H+ + 4e��=== 2H2O
C. ��·��ÿ����4 mol���ӣ�����������44.8 LH2S
D. ÿ17 g H2S���뷴Ӧ����1 mol H+������Ĥ����������
���𰸡�C
��������A������ͼʾ���缫a��H2Sʧȥ���ӱ�������S2���缫aΪ������A����ȷ��B���缫b��O2�����õ��ӵĻ�ԭ��Ӧ���缫��ӦʽΪO2+4H++4e-=2H2O��B����ȷ��C��H2S�ڸ��������ģ������缫��ӦʽΪ2H2S-4e-=S2+4H+����·������4mol���ӣ���������2molH2S��H2S�����¶Ⱥ�ѹǿδ֪������������H2S�������C�����D��n��H2S��=![]() =0.5mol���������������缫��Ӧʽ��ÿ17gH2S���뷴Ӧ��1molH+������Ĥ������������D����ȷ����ѡC��
=0.5mol���������������缫��Ӧʽ��ÿ17gH2S���뷴Ӧ��1molH+������Ĥ������������D����ȷ����ѡC��

��ϰ��ϵ�д�
 ���ɿ��õ�Ԫ����AB��ϵ�д�
���ɿ��õ�Ԫ����AB��ϵ�д� С�����ϵ�д�
С�����ϵ�д�
�����Ŀ