题目内容
【题目】(15分)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为 (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为 ,K的原子结构示意图为 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为 ;
②该产气药剂中NaN3的质量分数为 。
【答案】8.(15分)
(1)![]() (2)Fe (3)离子键和共价键
(2)Fe (3)离子键和共价键
(4)2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)①CO2、H2O ② 65%
【解析】
(1)氮原子最外层有5个电子,共用3对电子形成氮气,则N2的电子式为![]() 。
。
(2)因为Fe2O3与Na的反应为置换反应,所以Fe2O3作为氧化剂,与Na反应得电子生成Fe单质。
(3)KClO4 属于含氧酸盐,所以KClO4含有化学键的类型为离子键和共价键,K是19号元素,原子结构示意图为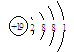
(4)NaHCO3热稳定性较差,受热分解生成碳酸钠、CO2和水,方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)①碱石灰的主要成分是NaOH和CaO,所以用碱石灰除去的物质为CO2、H2O;
②标准状况下33.6LN2的物质的量为1.5mol,根据N原子守恒,该产气药剂中NaN3的质量分数为(1.5×2÷3)×65÷100×100%=65%。

练习册系列答案
相关题目