题目内容
13.下列化学实验事实及其相应结论都正确的是( )| 实验事实 | 结论 | |
| A | 氯水可以导电 | 氯气是电解质 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 向浓度均为0.1mol.L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2<Ksp[Cu(OH)2] |
| D | 将SO2通入含HClO的溶液中,生成H2SO4 | 说明HClO酸性比H2SO4强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.电解质必须为化合物;
B.氧化铝的熔点高;
C.溶度积小的先生成沉淀;
D.SO2通入含HClO的溶液中,生成H2SO4,发生氧化还原反应.
解答 解:A.氯水中含自由移动的离子可以导电,但氯气为单质,不属于电解质,故A错误;
B.铝箔在酒精灯火焰上加热熔化但不滴落,是因铝箔表面氧化铝熔点高于铝,像网兜一样包裹在Al的外面使其不滴落,故B正确;
C.先出现蓝色沉淀为氢氧化铜,可知Ksp[Mg(OH)2>Ksp[Cu(OH)2],故C错误;
D.SO2通入含HClO的溶液中,生成H2SO4,发生氧化还原反应,不能比较酸性的强酸,实际上硫酸为强酸,而HClO为弱酸,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、反应原理等为解答的关键,注意实验的评价性分析,侧重电解质、沉淀生成、氧化还原反应及酸性比较等知识考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
14.下表列出了前20号元素中的某些元素性质的有关数据:试回答下列问题:
(1)以上10种元素的原子中,最容易失电子的是K(填写元素符号).
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl3、CCl4(写分子式).某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是第三周期ⅥA族;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式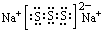 .
.
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式KC8.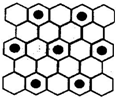
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是PCl3、CCl4(写分子式).某元素R的原子半径为1.02×10-10m,该元素在周期表中的位置是第三周期ⅥA族;若物质Na2R2是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
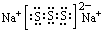 .
.(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中“●”表示元素②的原子),右图为该物质部分原子分布示意图,请根据图找出原子排列规律并写出该物质的化学式KC8.

4.下列各实验操作以及目的都正确的是( )
| A. | 为减缓反应速率,将饱和食盐水滴加到烧瓶中的电石上来制取乙炔 | |
| B. | 实验室制乙烯时应将无水乙醇缓慢加入到浓硫酸中,并加入碎瓷片以防暴沸 | |
| C. | 将浓氨水逐滴加入到2%的硝酸银溶液中至产生的沉淀恰好溶解即制得银氨溶液 | |
| D. | 苯甲酸的重结晶实验中,粗苯甲酸全溶后再加入少量蒸馏水,目的是有利于趁热过滤 |
1.下列说法正确的是( )
| A. | 在CH3COONa溶液中存在CH3COOH分子,且c(CH3COOH)大于c(CH3COO-) | |||||||||||
| B. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释,c(H+)/c(HF)始终保持增大 | |||||||||||
| C. | 已知:
 的△H为-384kJ•mol-1 的△H为-384kJ•mol-1 | |||||||||||
| D. | 常温下,在0.10 mol•L-1的氨水中加入少量NH4Cl晶体,溶液的pH不变 |
8.下列有关工业生产叙述正确的是( )
| A. | 电解精炼铜时,同一时间内阳极溶解铜的质量比比阴极析出铜的质量小 | |
| B. | 高炉炼铁时,增加高炉高度,延长CO和铁矿石的接触时间,可以提高CO利用率 | |
| C. | 硫酸工业中,接触室内安装热交换器,是为了将SO2完全转化为SO3 | |
| D. | 侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
18.我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大.元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E所对应的元素符号或对应的微粒化学式作答)
(1)元素E在周期表中的位置为第四周期第IB族.
(2)写出A2D2分子的电子式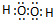 .
.
(3)A、C、D以原子个数比4:2:3形成的化合物,其水溶液的pH<7(填“>”、“<”或“=”),原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)CD3-离子的空间构型为平面三角形.B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(5)将过量C的气态氢化物通入E的硫酸盐溶液中,反应生成了一种组成较为复杂的物质,其化学式为[Cu(NH3)4]SO4,该化合物中存在的化学键类型有ABC(填字母).
A、离子键B、共价键C、配位键D、金属键.
| 元素 | 原色性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的原子轨道且各种原子轨道所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
(1)元素E在周期表中的位置为第四周期第IB族.
(2)写出A2D2分子的电子式
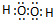 .
.(3)A、C、D以原子个数比4:2:3形成的化合物,其水溶液的pH<7(填“>”、“<”或“=”),原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)CD3-离子的空间构型为平面三角形.B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是N2H4分子之间存在氢键.
(5)将过量C的气态氢化物通入E的硫酸盐溶液中,反应生成了一种组成较为复杂的物质,其化学式为[Cu(NH3)4]SO4,该化合物中存在的化学键类型有ABC(填字母).
A、离子键B、共价键C、配位键D、金属键.
5.在常温下,用pH=11的某碱溶液分别与pH均为3的醋酸溶液和盐酸等体积混合,得到a、b两种溶液,关于这两种溶液的酸碱性的叙述正确的是( )
| A. | a不可能显中性 | B. | a只能显碱性 | C. | b不可能显酸性 | D. | b只能显中性 |
2.NaH是一种离子化合物,跟水反应的化学方程式为:NaH+H2O═NaOH+H2↑,现有a mol NaH与b mol Al粉混合物跟足量的水反应(a<b),在标准状况下可收集到氢气的量为( )
| A. | 56a L | B. | (a+b)mol | C. | 56b L | D. | (a+b)mol |
3.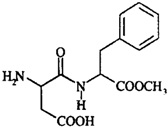 阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
 阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )
阿斯巴甜具有清爽的甜味,甜度约为蔗糖的200倍,其结构简式如图所示.下列关于阿斯巴甜的说法错误的是( )| A. | 阿斯巴甜属于糖类 | |
| B. | 在一定条件下完全水解,产物中有两种氨基酸 | |
| C. | 既能与酸反应又能与碱反应 | |
| D. | 可发生取代反应和加成反应 |