题目内容
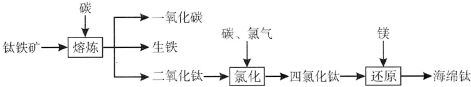
8.下列有关工业生产叙述正确的是( )| A. | 电解精炼铜时,同一时间内阳极溶解铜的质量比比阴极析出铜的质量小 | |
| B. | 高炉炼铁时,增加高炉高度,延长CO和铁矿石的接触时间,可以提高CO利用率 | |
| C. | 硫酸工业中,接触室内安装热交换器,是为了将SO2完全转化为SO3 | |
| D. | 侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
分析 A.电解精炼粗铜时,阳极上有铜及比铜活泼的金属失电子发生氧化反应,阴极上只有铜离子发生还原反应;
B.物质的转化率与反应时间无关;
C.可逆反应中反应物不能完全转化为生成物;
D.碳酸氢钠受热分解即可得到碳酸钠.
解答 解:A.电解精炼粗铜时,阳极上有铜及比铜活泼的金属失电子发生氧化反应,阴极上只有铜离子发生还原反应,所以阳极溶解的铜的质量比阴极析出的铜的质量少,故A正确;
B.物质的转化率与反应时间无关,故B错误;
C.硫酸工业中,在接触室安热交换器,目的是将放出的热量用来预热没反应的二氧化硫与氧气的混合气体,可逆反应中反应物不能完全转化为生成物,有一定反应限度,故C错误;
D.向饱和食盐水中通入氨气再通入二氧化碳即可生成碳酸氢钠固体,碳酸氢钠受热分解即可得到碳酸钠,故D错误;
故选A.
点评 本题考查较综合,涉及电解精炼、可逆反应特点、物质制备等知识点,明确反应原理是解本题关键,易错选项是B,注意转化率与反应时间长短无关,与温度等外界条件有关,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.已知热化学方程式:2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ•mol-1(Q>0).下列说法中正确的是( )
| A. | 相同条件下,2 mol SO2(g)和1 mol O2(g)的键能之和大于2 mol SO3(g)的键能 | |
| B. | 一定量SO2(g)和O2(g)置于密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 | |
| C. | 恒温恒压下,在上述已达到平衡的体系中加入高效催化剂,SO2的转化率一定增大 | |
| D. | 将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
19.超高相对分子质量、性能更优的聚乙烯树脂具有高强度和高耐磨性,可以作为做防弹头盔和防弹衣的材料.对于这种聚乙烯树脂,下列说法正确的是( )
| A. | 它不能燃烧 | |
| B. | 它能使酸性高锰酸钾溶液褪色 | |
| C. | 它是一种高分子纯净物 | |
| D. | 它的单体与家用保鲜膜塑料的单体相同 |
16.下列说法中正确的是( )
| A. | 丙烯能使溴的四氯化碳溶液褪色,还可能在一定条件下与溴发生取代反应 | |
| B. | 正丁烷比丙烷难液化 | |
| C. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| D. | 乙醇的催化氧化也属于加成反应 |
13.下列化学实验事实及其相应结论都正确的是( )
| 实验事实 | 结论 | |
| A | 氯水可以导电 | 氯气是电解质 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| C | 向浓度均为0.1mol.L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2<Ksp[Cu(OH)2] |
| D | 将SO2通入含HClO的溶液中,生成H2SO4 | 说明HClO酸性比H2SO4强 |
| A. | A | B. | B | C. | C | D. | D |
17.表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)
(1)据表中数据,总结烯类化合物与溴发生加成反应时,反应速率与碳酸双键上取代基的种类、个数间的关系为碳碳双键上的烷基取代基越多越有利于加成,有卤素原子不利于加成
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D(填代号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH3 C.CH2=CH2 D.CH2=CHCl
(3)已知化合物A与化合物B 的转化关系如下,且化合物B中仅有4个碳原子、1个溴原子、1种氢原子
A$\stackrel{Br_{2}、光照}{→}$B则A的名称为异丁烷,B的结构简式为 ;该反应的反应类型是取代反应.
;该反应的反应类型是取代反应.
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
(2)下列化合物与氯化氢加成时,取代基对速率的影响与上述规律类似,其中反应速率最慢的是D(填代号).
A.(CH3)2C=C(CH3)2 B.CH3CH=CHCH3 C.CH2=CH2 D.CH2=CHCl
(3)已知化合物A与化合物B 的转化关系如下,且化合物B中仅有4个碳原子、1个溴原子、1种氢原子
A$\stackrel{Br_{2}、光照}{→}$B则A的名称为异丁烷,B的结构简式为
 ;该反应的反应类型是取代反应.
;该反应的反应类型是取代反应.
18.肉桂醛是GB2076-2011规定允许使用的食品香料,其结构简式如图.下列说法不正确的是( )

| A. | 1mol该物质最多可与2molH2发生加成反应 | |
| B. | 该物质的分子式为C9H8O | |
| C. | 加热时,该物质能与新制Cu(OH)2悬浊液反应 | |
| D. | 该物质既能发生加成反应,也能发生取代反应 |