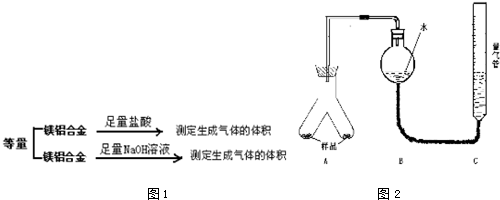
题目内容
1.下列反应的离子方程式书写正确的是( )| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2与HI的反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
分析 A.不符合反应客观事实;
B.碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
C.Fe (NO3)2与过量的HI的反应生成碘化亚铁、碘和一氧化氮、水;
D.次氯酸根具有强的氧化性,能够氧化二氧化硫.
解答 解:A.氯化铝溶液中加入过量的氨水,离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3 NH4+,故A错误;
B.用小苏打治疗胃酸过多,离子方程式:HCO3-+H+=CO2↑+H2O,故B正确;
C.Fe (NO3)2与过量的HI的反应,离子方程式:2NO3-+8H++6I-=3I2+2NO↑+4H2O,故C错误;
D.少量SO2通入漂白粉溶液中,发生氧化还原反应离子方程式为:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,注意离子反应遵循客观事实、注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
相关题目
12.下列过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 溴蒸气被木炭吸附 | ||
| C. | 酒精溶于水 | D. | HCl气体溶于水 |
9.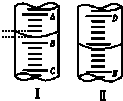 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2 mL,Ⅱ中是9.40 mL | B. | Ⅰ中是10.8 mL,Ⅱ中是9.40 mL | ||
| C. | Ⅰ中是9.2 mL,Ⅱ中是10.60 mL | D. | Ⅰ中是10.8 mL,Ⅱ中是10.60 mL |
16.下列递变情况中不正确的是( )
| A. | 碳、氮、氧、氟的原子半径依次增大 | |
| B. | 硅、磷、硫、氯元素的最高正化合价依次升高 | |
| C. | 钠、镁、铝原子的最外层电子数依次增多 | |
| D. | 锂、钠、钾、铷的金属性依次增强 |
6.下列叙述正确的是( )
| A. | 20g重水(D2O)含有的电子数为10 NA | |
| B. | 46g NO2和N2O4的混合物中所含氧原子个数为6.02×1023 | |
| C. | 0.1mol过氧化钠与足量的水反应,转移的电子数为 0.2NA | |
| D. | 1L 0.3 mol/LNa2SO4溶液中,含有Na+和SO42-总数为0.6 NA |
10.已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相等,而Z原子的最外层电子数是次外层的3倍,Y和Z可以形成两种以上常温下呈气态的化合物,则下列说法错误的是( )
| A. | X、Y、Z三种元素可以组成一种盐 | |
| B. | Y和Z可以组成一种Y和Z的质量比为7:8的化合物 | |
| C. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒都有2种 | |
| D. | X和Z可以组成原子个数比分别为1:1和2:1常温下为液态的两种化合物 |

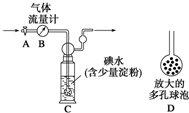 硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案: