题目内容
11.CO是水煤气的主要成份之一,是一种无色剧毒气体,根据信息完成下列各题Ⅰ、已知下列热化学方程式
2C(s)+O2(g)=2CO(g)△H=-221kJ/mol

C(s)+O2(g)=CO2(g)△H=-393kJ/mol
24g单质碳在不足量的O2中燃烧时,生成等物质的量的CO和CO2气体,则和24g单质碳完全燃烧生成CO2相比较,损失热量282.5kJ
Ⅱ、850℃时,在10L体积不变的容器中投入2molCO和3molH2O,发生如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g)当CO的转化率达60%时,反应达平衡
(1)850℃时,该反应的平衡常数为1
(2)该条件下,将CO和H2O都改为投入2mol,达平衡时,H2的浓度为0.1mol/L,下列情况能说明该反应一定达平衡的是C,
A.CO和H2O蒸气的浓度之比不再随时间改变
B.气体的密度不再随时间改变
C.CO和CO2的浓度之比不再随时间改变
D.气体的平均摩尔质量不再随时间改变
Ⅲ、为防止CO使人中毒,一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇、氧化钠,其中
O2-可以在固体NASICON中自由移动,则:
(1)该原电池中通入CO的电极为负极,该电极的电极反应式为CO-2e-+O2-=CO2
(2)通空气一极的电极反应式为O2+4e-=2O2-.
分析 I、利用盖斯定律计算出CO燃烧的热化学反应方程式,计算出反应热,碳不完全燃烧损失的热量为生成的一氧化碳燃烧放出的热量.根据碳原子守恒计算出一氧化碳的物质的量,再根据一氧化碳燃烧的热化学方程式计算;
II、(1)根据平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值进行解答;
(2)依据温度不变,平衡常数不变,利用三段法计算即可,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,据此解答即可;
III、该装置属于原电池,一氧化碳失电子发生氧化反应生成二氧化碳,则通入一氧化碳的电极为负极,正极上氧气得电子发生还原反应,据此解答即可.
解答 解:Ⅰ、2C(s)+O2(g)=2CO(g)△H=-221kJ/mol (i)
C(s)+O2(g)=CO2(g)△H=-393kJ/mol (ii)
[(ii)×2-(i)]÷2得:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=$\frac{1}{2}$[(-393)×2-(-221)]=-282.5kJ/mol,24g碳的物质的量为$\frac{24g}{12g/mol}$=2mol,生成等物质的量的CO和CO2气体,所以CO的物质的量为1mol,由于CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-285.kJ/mol,所以1molCO燃烧放出的热量为282.5kJ/mol×1mol=282.5kJ
即24g碳不完全燃烧生成1molCO损失的热量为282.5kJ,故答案为:282.5;
Ⅱ、(1)CO转化率为60%,即CO转化浓度为:$\frac{2mol×60%}{10L}$=0.12mol/L,利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度/(mol•L-1 ):0.2 0.3 0 0
转化浓度/(mol•L-1 ):0.12 0.12 0.12 0.12
平衡浓度/(mol•L-1 ):0.08 0.18 0.12 0.12
因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K(850℃)=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{0.12×0.12}{0.08×0.18}$=1,故答案为:1;
(2)将CO和H2O都改为投入2mol,则此时浓度均为0.2mol/L,利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度/(mol•L-1 ):0.2 0.2 0 0
转化浓度/(mol•L-1 ):x x x x
平衡浓度/(mol•L-1 ):0.2-x 0.2-x x x,此时有K=$\frac{x×x}{(0.2-x)×(0.2-x)}$=1,解x=0.1,A.CO和H2O蒸气的浓度之比不再随时间改变不能说明平衡,因为投料是相等的,且两者化学计量数之比为1:1,故任何时候均满足两者1:1的关系,故A错误;
B.气体的密度不再随时间改变,不能说明达到平衡,气体的质量不变,容器的体积不变,故密度不变,故B错误;
C.CO和CO2的浓度之比不再随时间改变,两者分别为反应物和生成物,若浓度比不变,说明达到平衡,故C正确;
D.气体的平均摩尔质量不再随时间改变,不能说明,因为气体质量不变,物质的量不变,故D错误,故选C;故答案为:0.1;C;
Ⅲ、(1)负极为失去电子发生氧化反应的一极,一氧化碳失电子和氧离子反应生成二氧化碳,故通入CO的电极为负极,电极反应式为CO+O2--2e-=CO2,故答案为:负;CO-2e-+O2-=CO2;
(2)依据“O2-可以在固体NASICON中自由移动”,即正极为氧气得到电子生成氧负离子,电极方程式为:O2+4e-=2O2-,故答案为:O2+4e-=2O2-.
点评 本题主要考查了盖斯定律的应用、热化学反应的计算、原电池工作原理、以及化学平衡的有关计算的是否达到平衡的计算,综合性较强,难度较大.

| A. | 若M的最高正化合价为+4,则五种元素都是非金属元素 | |
| B. | HnJOm为强酸,则G是位于ⅤA族以后的活泼非金属元素 | |
| C. | 若T的最低化合价为-3,则J的最高正化合价为+7 | |
| D. | 若R、M的最高价氧化物的水化物均为碱,则R(OH)n的碱性一定比M(OH)n+1的碱性强 |
(1)写出该反应的平衡常数表达式:K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$; K( 200℃)> K( 300℃)(填“>”、“=”或“<”).
(2)在773K时,一氧化碳变换反应的平衡常数K=9,如反应开始时CO和H2O的浓度都是0.020•mol-l,则在此反应条件下一氧化碳的转化率为75%.
(3)某工业合成氨的原料气组成为:H2 40%、N2 20%、CO30%、CO210%(均为体积分数).现采用“一氧化碳变换”法,向上述原料气中加入水蒸气,以除去其中的CO.已知不同温度及反应物投料比($\frac{n{H}_{2}O}{n(CO)}$ )下,变换后平衡混合气体中CO的体积分数如下表所示:
| 投料比 CO体积分数/% 温度/℃ | $\frac{n{H}_{2}O}{n(CO)}$=1 | $\frac{n{H}_{2}O}{n(CO)}$=3 | $\frac{n{H}_{2}O}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
②温度是一氧化碳变换工艺中最重要的工艺条件,实际生产过程中将温度控制在300℃左右,其原因是提高温度,会提高反应速率,但平衡逆向移动,CO的转化率下降,实际生产过程中应该综合考虑速率和平衡两个方面.
③温度为300℃、$\frac{n{H}_{2}O}{n(CO)}$=1时,变换后的平衡混合气体中CO2的体积分数是24.8%.(结果保留3位有效数字).
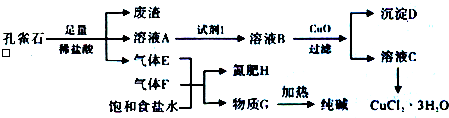
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示.回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| PH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)孔雀石的主要成分与足量稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用BD(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离.则pH的范围为3.2≤pH<4.7.
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是F、NH3(填代号及对应物质的化学式).
(6)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(7)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.
| A. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
 关系相互转化的是(“→”表示一步完成)( )
关系相互转化的是(“→”表示一步完成)( )| 选项 | A | B | C | D |
| a | SiO2 | NaOH | HNO3 | Cu |
| b | Na2SiO3 | Na2CO3 | NO | CuSO4 |
| c | H2SiO3 | NaHCO3 | NO2 | Cu(OH)2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2与HI的反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
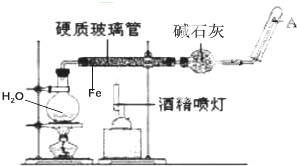 如图是在高温下,Fe与水蒸气的反应实验.
如图是在高温下,Fe与水蒸气的反应实验.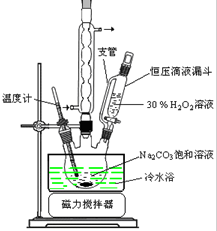 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.