题目内容
6.下列叙述正确的是( )| A. | 20g重水(D2O)含有的电子数为10 NA | |
| B. | 46g NO2和N2O4的混合物中所含氧原子个数为6.02×1023 | |
| C. | 0.1mol过氧化钠与足量的水反应,转移的电子数为 0.2NA | |
| D. | 1L 0.3 mol/LNa2SO4溶液中,含有Na+和SO42-总数为0.6 NA |
分析 A、D2O分子中含有10个电子,20个重水的物质的量为1mol,含有10mol电子;
B、NO2和N2O4的最简式均为NO2;
C、过氧化钠与水的反应为歧化反应;
D、1molNa2SO4中含2mol钠离子和1molSO42-.
解答 解:A、20克D2O的物质的量为1mol,1mol重水中含有10mol电子,含有的电子数为10NA,故A正确;
B、NO2和N2O4的最简式均为NO2,故46g NO2和N2O4的混合物中含有NO2的物质的量n=$\frac{m}{M}$=$\frac{46g}{46g/mol}$=1mol,故含有2mol氧原子,故B错误;
C、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1mol电子,故C错误;
D、1L 0.3 mol/LNa2SO4溶液中含Na2SO4的物质的量为0.3mol,而1molNa2SO4中含2mol钠离子和1molSO42-,故0.3molNa2SO4中含有的钠离子和硫酸根的物质的量为0.9mol,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物.以孔雀石为原料可制备CuCl2•3H2O及纯碱,流程如图.
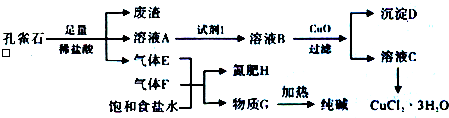
且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示.回答下列问题:
(1)孔雀石研磨的目的是增大固体表面积,从而增大反应速率.
(2)孔雀石的主要成分与足量稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用BD(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离.则pH的范围为3.2≤pH<4.7.
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是F、NH3(填代号及对应物质的化学式).
(6)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(7)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.

且知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀的pH如下表所示.回答下列问题:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| PH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(2)孔雀石的主要成分与足量稀盐酸反应的化学方程式为Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑.
(3)使用上图中“试剂1”的目的是将溶液中的Fe2+转化为Fe3+,试剂B宜选用BD(填选项序号).
A.酸性KMnO4溶液 B.双氧水 C.浓硝酸 D.氯水
(4)加入CuO作用是调节溶液pH,使Fe3+转化为沉淀予以分离.则pH的范围为3.2≤pH<4.7.
(5)气体E、F与饱和食盐水作用生成H和G时,E和F应按一定先后顺序通入饱和食盐水中,其中,应先通入气体是F、NH3(填代号及对应物质的化学式).
(6)由溶液C获得CuCl2•3H2O,需要经过蒸发浓缩、冷却结晶、过滤等操作.
(7)已知:常温下Cu(OH)2的Ksp=2×10-20.计算Cu2++2H2O?Cu(OH)2+2H+反应平衡常数5×10-9.
14.下列关于元素周期表的说法正确的是( )
| A. | 18个纵横代表18个族,7个主族、8个副族 | |
| B. | 短周期共有32种元素 | |
| C. | 元素周期表共有七个横行代表七个周期 | |
| D. | 第IA族全部是金属元素 |
1.下列反应的离子方程式书写正确的是( )
| A. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | Fe (NO3)2与HI的反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O | |
| D. | 少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
15.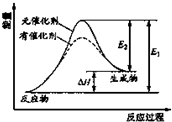 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
 某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )
某反应的过程中能量辩护如图实数(图中E1表示正反应的活化能,E2表示逆反应的活化能),下列叙述制取的是( )| A. | 该反应为放热反应 | |
| B. | 催化解能改变反应的焓变 | |
| C. | 催化解能降低反应所需活化能,增大活化分子百分数 | |
| D. | 逆反应的活化能大于正反应的活化能 |
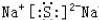 .
. (1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑
(1)已知 2Na+2H2O=2NaOH+H2↑中水是氧化剂,请写出一个水做还原剂的置换反应的化学反应方程式2F2+2H2O=4HF+O2↑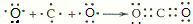 ;用电子式表示C、D两元素形成化学键的过程
;用电子式表示C、D两元素形成化学键的过程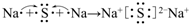 .
.