题目内容
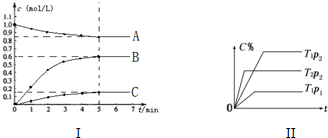
18.图I中表示在2L的密闭容器中、T1温度下,某可逆反应各物质浓度与时间关系;图II表示当其它条件不变时,C物质的体积分数(C%)与温度(T)和压强(p)的关系.回答下列问题:(1)该可逆反应的化学方程式为A?4B+C.
(2)上述反应的压强p1大于 p2,反应的焓变△H小于0(填“大于”、“小于”或“等于”)
(3)若温度T1时,5min后反应达到平衡,则
①平衡时体系总的物质的量为3.2mol.②反应的平衡常数K=$\frac{{c}^{4}(B)•c(C)}{c(A)}$=$\frac{(0.6)^{4}×0.15}{0.85}$≈0.023.(列式计算)
③反应在0~5min区间的平均反应速率v(B)=0.12mol/(L•min).
分析 (1)根据图Ⅰ计算出A、B、C的物质的量浓度变化,在根据浓度变化与物质的量成正比计算出各自计量数,据此写出该反应的方程式;
(2)相同温度时,压强越大,反应速率越快,优先达到平衡状态;相同压强时,反应速率越快,温度越高,然后根据升高温度,平衡向着吸热反应方向移动判断反应热;
(3)①根据图象可知,达到平衡时A的浓度为0.85mol/L、B、C的浓度都分别为0.6mol/L、0.15mol/L,然后根据n=cV计算出各自的物质的量,再计算出总物质的量即可;
②根据平衡常数的表达式K=$\frac{{c}^{4}(B)•c(C)}{c(A)}$及平衡时各组分浓度进行计算;
③根据反应速率的表达式v=$\frac{△c}{△t}$计算.
解答 解:(1)根据图象Ⅰ可知,达到平衡时A的浓度从1.0mol/L变为0.85mol/L、B、C的浓度都从0分别变为0.6mol/L、0.15mol/L,则A为反应物、BC为生成物,A、B、C的浓度变化之比为:(1.0-0.85)mol/L:(0.6-0)mol/L:(0.15mol/L-0)=1:4:1,所以该反应方程式为:A?4B+C,
故答案为:A?4B+C;
(2)根据图Ⅱ中T1p1、T1p2曲线可知,T1p2时优先达到平衡状态,说明该反应速率大,则压强大小为:p1大于p2;
根据曲线T1p2、T2p2可知,T2p2先达到平衡,则T2温度较高,说明升高温度,C的百分含量越小,则升高温度平衡向着逆向移动,该反应为放热反应,△H小于0,
故答案为:大于;小于;
(3)①根据图Ⅰ可知,达到平衡时A的浓度为0.85mol/L,B、C的浓度都分别为0.6mol/L、0.15mol/L,则总物质的量为:(0.85mol/L+0.6mol/L+0.15mol/L)×2L=3.2mol,
故答案为:3.2mol;
②达到平衡时A的浓度为0.85mol/L,B、C的浓度都分别为0.6mol/L、0.15mol/L,则平衡常数为:K=$\frac{{c}^{4}(B)•c(C)}{c(A)}$=$\frac{(0.6)^{4}×0.15}{0.85}$≈0.023,
故答案为:0.023;
③反应在0~5min区间B的浓度变化为:△B=0.6mol/L-0=0.6mol/L,B的平均反应速率为:v(B)=$\frac{0.6mol/L}{5min}$=0.12mol/(L•min),
故答案为:0.12mol/(L•min).
点评 本题考查了物质的量浓度随时间变化的曲线、化学反应速率、化学平衡的计算,题目难度中等,熟练掌握化学平衡及其影响因素为解答根据,注意掌握化学反应速率、化学平衡常数的表达式及计算方法,试题培养了学生的分析能力及化学计算能力.

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案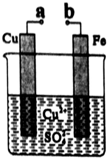
| A. | 无论a和b是否连接,该装置的反应原理相同 | |
| B. | a和b分别连接直流电源正、负极可以实现铁上镀铜 | |
| C. | a和b不连接时反应速率比a和b用导线连接时的速率慢 | |
| D. | 在a、b之间连接一小灯泡,改变Cu2+的浓度不会影响灯泡亮度 |
| A. | 生石灰 | B. | 食盐 | C. | 浓硫酸 | D. | 硝酸铵 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 原子半径:Se>S | B. | 沸点:H2S>H2Se | ||
| C. | 稳定性:H2S>H2Se | D. | 酸性:H2SO4>H2SeO4 |
| A. | 玻璃容器可长期盛放各种酸 | B. | P2O5可用于干燥Cl2和NH3 | ||
| C. | Si和SiO2都用于制造光导纤维 | D. | Na2S可除去污水中的Cu2+ |
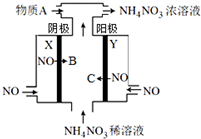 电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )
电解NO制备 NH4NO3的工作原理如图所示,X、Y皆为Pt电极,为使电解产物全部转化为NH4NO3,需补充物质A.下列说法正确的是( )| A. | 在阴极NO转化为B,B为硝酸根离子 | |
| B. | 电解一段时间,阴极附近pH升高 | |
| C. | 为使电解产物全部转化为NH4NO3,需补充的A为硝酸 | |
| D. | 该电解池的阳极反应式为:NO-3e-+4OH-=NO${\;}_{3}^{-}$+2H2O |
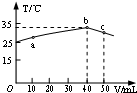 25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述不正确的是( )| A. | b点时酸碱恰好完全反应 | |
| B. | a→b的过程中,混合溶液中可能存在:c(A)=c(Na+) | |
| C. | HA溶液的物质的量浓度为0.01mol•L-1 | |
| D. | 25℃时,HA的电离平衡常数K约为1.43×10-3 |
| A. | Y与Z形成的两种化合物中所含化学键类型完全相同 | |
| B. | 化合物X2W比化合物X2Y稳定 | |
| C. | Y、Z、W三种元素形成的化合物的水溶液一定呈中性 | |
| D. | 原子半径:r(Z)>r(W)>r(Y)>r(X) |