题目内容
【题目】CO2、CO可与H2在一定条件下反应合成二甲醚(CH3OCH3)、甲醇(CH3OH)、草酸(H2C2O4)等化工原料。
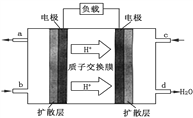
(1)二甲醚可作为绿色环保型能源。二甲醚空气燃料电池的工作原理如图所示。该电池工作时,c通入的物质为______________ ,该电极的电极反应式为_______________。
(2)某同学用甲醇和其它试剂组装了如下图所示装置,来研究有关电化学问题(甲、乙、丙三池中电解质足量)。当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
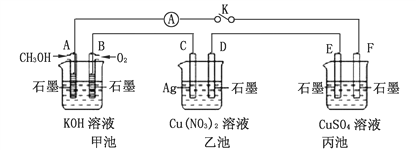
①丙池中F电极为____________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为_______________;
②若丙池溶液的体积为500 mL,当乙池中C极质量减轻5.4g时,丙池溶液的pH为_______(忽略溶液体积的变化);
③一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是______ (填序号)。
A. Cu B. CuO C. Cu(OH)2 D. Cu2(OH)2CO3
(3)已知:常温下,H2C2O4的电离常数分别是Ka1≈5.0×10-2,Ka2≈6.0×l0-5。草酸的钾盐有K2C2O4、KHC2O4。常温下,KHC2O4的水解常数Kh2=___________,KHC2O4溶液的pH______7(填“﹥”、“﹤”或“=”)。
【答案】 O2或空气 O2+4H++4e- === 2H2O 阴极 2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑ 1 A 2.0×10-13 <
2H2SO4+2Cu+O2↑ 1 A 2.0×10-13 <
【解析】(1)本题考查燃料电池,以及电极反应式的书写,根据原电池的工作原理,电解质的阳离子向正极移动,即电池右端为正极,左端为负极,即c通入的物质为O2或空气,根据电池的工作原理,因此正极反应式为O2+4H++4e-=2H2O;(2)考查原电池和电解池的综合应用,①甲池为燃料电池,乙池、丙池为电解池,甲池中通氧气一极为正极,即B为正极,A为负极,F电极连接A,即F为阴极,该池电解硫酸铜溶液,总电极反应方程式为2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑;②C极反应式为Ag-e-=Ag+,丙池中E电极反应式为2H2O-4e-=4H++O2↑,串联电路中通过的电量是相同的,因此关系式有4Ag~4e-~4H+,n(H+)=5.4/108mol=0.05mol,c(H+)=0.05/500×10-3mol·L-1=0.1mol·L-1,即溶液的pH=1;③乙池中总电极反应方程式为2Ag+Cu2+
2H2SO4+2Cu+O2↑;②C极反应式为Ag-e-=Ag+,丙池中E电极反应式为2H2O-4e-=4H++O2↑,串联电路中通过的电量是相同的,因此关系式有4Ag~4e-~4H+,n(H+)=5.4/108mol=0.05mol,c(H+)=0.05/500×10-3mol·L-1=0.1mol·L-1,即溶液的pH=1;③乙池中总电极反应方程式为2Ag+Cu2+![]() 2Ag++Cu,因此恢复到反应前的浓度,需要加入铜单质,故选项A正确;(3)本题考查三大平衡常数的应用,Kh2=
2Ag++Cu,因此恢复到反应前的浓度,需要加入铜单质,故选项A正确;(3)本题考查三大平衡常数的应用,Kh2=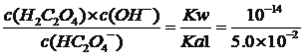 =2×10-13<6.0×10-5,说明HC2O4-的电离程度大于其水解,溶液显酸性,即KHC2O4溶液的pH<7。
=2×10-13<6.0×10-5,说明HC2O4-的电离程度大于其水解,溶液显酸性,即KHC2O4溶液的pH<7。