题目内容
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是

A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
【答案】D
【解析】从电解的示意图可知,最后要得到0.5mol/L的盐酸溶液,因此阴极室内,Ni2++2e-=Ni,溶液中氯离子通过离子交换膜b进入浓缩室内,因此,交换膜b为阴离子交换膜,A正确;电解质为硫酸溶液,阳极内时氢氧根离子失电子生成氧气,极反应式为2H2O-4e-=O2↑+4H+,产生的氢离子通过阳离子交换膜进入浓缩室内,B正确;阴极液pH=1时,溶液中氢离子浓度较大,2H++2e-=H2↑,Ni2+被还原的量减少,因此镍的回收率低,C正确;根据题意可知,浓缩室得到1L 0.5 mol/L盐酸时,新生成的盐酸溶质的量为0.5-0.1=0.4 mol,即阴极有0.4 mol氯离子进入浓缩室,阴极共得电子0.4 mol,若全部为镍离子得电子,根据极反应Ni2++2e-=Ni可知,转移电子0.4 mol 生成11.8 g镍,但是溶液中还会有少量的氢离子得电子,所以生成的镍的质量少于11.8 g,D错误;正确选项D。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | K=1.77×10-4 | K=5.0×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
下列叙述错误的是
A. NaCN溶液中通人少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3-
B. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
C. 等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+)
D. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
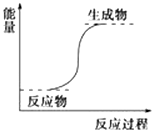
①下图能正确表示该反应中能量变化的是________;

②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。