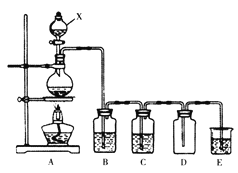
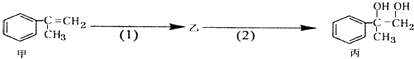
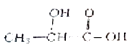题目内容
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
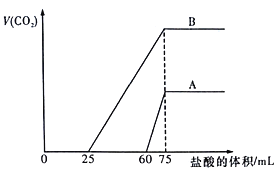
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
【答案】C
【解析】A、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成。假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积小于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是碳酸钠和碳酸氢钠,所以B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:H++CO32-=HCO3-,故A错误;B、先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,盐酸和氢氧化钠反应的物质的量之比为1:1,设氢氧化钠的物质的量浓度为cmol/L,0.1L×cmol/L=0.1mol/L×0.075L,c=0.075,故B错误;C、通过C知,B溶液中的溶质是碳酸钠和碳酸氢钠,碳酸钠和盐酸反应生成碳酸氢钠,有气体生成的化学反应方程式为:HCO3-+H+=H2O+CO2↑,所以当盐酸的为25mL时有二氧化碳生成,即发生的化学反应为:HCO3-+H+=H2O+CO2↑,生成的二氧化碳的物质的量= n(H+)=0.1mol/L×(0.075L-0.025L)=0.005mol,则二氧化碳的体积=0.005mol ×22.4L/mol =0.112L=112mL,故C正确;D、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积远远大于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是氢氧化钠和碳酸钠,故D错误;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案