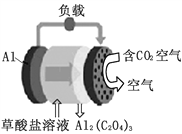
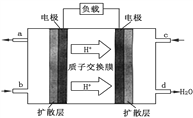
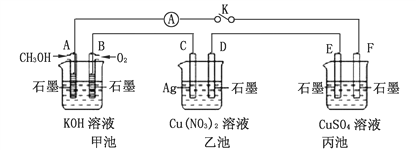
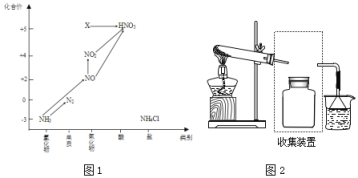
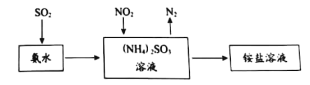
题目内容
【题目】A、B、C、D、E为原子序数依次增大的前四周期元素,A是原子半径最小的元素,B元素有两个未成对电子,D元素的最外层电子是内层电子数的三倍,E的单质是自然界中最硬的金属,常用于制作合金,且其未成对电子数在同周期中最多。回答下列问题:
(1)利用原子发生跃迁时吸收或释放出的光用于鉴定E元素,该方法是________,其价层电子排布图为____________,根据_____________原理,该基态原子的电子排布应使其能量处于最低状态。
(2)根据电子排布,C元素处于周期表中_______区;根据元素周期律,电负性B_______C,第一电离能C________D(填“大于”、“小于”或者“等于”)。
(3)化合物A2D分子空间构型是_____________;A与C以原子个数比2:1形成的分子中C原子的杂化方式为_________,它是_________分子(填“极性”或“非极性”),且该分子可以与很多金属离子形成配合物,其中提供孤对电子的原子是____________(填元素符号)。
(4)生活中常见的B元素的同素异形体有两种,其结构为图1、图2所示:
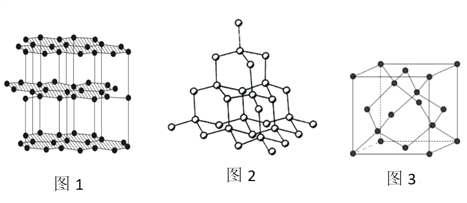
①图1所对应的同素异形体可以导电,试从其结构予以解释_________。
②图2所对应的同素异形体的晶胞如图3,若B原子的半径为a nm,则该晶胞的空间利用率为_____________。(![]() =1.732,结果保留一位小数)
=1.732,结果保留一位小数)
【答案】 光谱分析 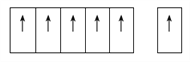 能量最低原理 P 小于 大于 V形 SP3 极性 N 石墨的片层结构上所有的P轨道互相平行且相互重叠,使P轨道中的电子可在整个碳原子平面中运动。 34.0%
能量最低原理 P 小于 大于 V形 SP3 极性 N 石墨的片层结构上所有的P轨道互相平行且相互重叠,使P轨道中的电子可在整个碳原子平面中运动。 34.0%
【解析】(1)光谱分析利用原子的特征光谱对原子进行鉴定,根据能量最低原理,3d轨道和4s轨道半充满状态最稳定,故Cr原子的电子排布较特殊;利用原子发生跃迁时吸收或释放出的光用于鉴定Cr元素,该方法是光谱分析,其价层电子排布图为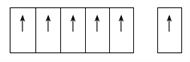 ,根据能量最低原理原理,该基态原子的电子排布应使其能量处于最低状态;(2)可以推测A为H,D可以推测为O,则B为C,而C只能是N,N处于P区,电负性同一周期从左到右增大,则C小于N,第一电离能由于N原子处于半充满状态,能量低,第一电离能大,故N大于O;(3)H2O的构型为V形,N2H4中N原子有孤对电子,有三对成键电子对,故价层电子对为4,为SP3杂化,由于N2H4的非对称结构,是极性分子;N原子可以提供孤独电子形成配位键,故其中提供孤对电子的原子是N;(4)①石墨的片层结构上所有的P轨道互相平行且相互重叠,使P轨道中的电子可在整个碳原子平面中运动,故能导电;②该晶胞体对角线应该是5个C原子无隙并置,则体对角线长为8a,该晶胞中含8个C原子,列式为(8×4/3πa3)/ (8a/
,根据能量最低原理原理,该基态原子的电子排布应使其能量处于最低状态;(2)可以推测A为H,D可以推测为O,则B为C,而C只能是N,N处于P区,电负性同一周期从左到右增大,则C小于N,第一电离能由于N原子处于半充满状态,能量低,第一电离能大,故N大于O;(3)H2O的构型为V形,N2H4中N原子有孤对电子,有三对成键电子对,故价层电子对为4,为SP3杂化,由于N2H4的非对称结构,是极性分子;N原子可以提供孤独电子形成配位键,故其中提供孤对电子的原子是N;(4)①石墨的片层结构上所有的P轨道互相平行且相互重叠,使P轨道中的电子可在整个碳原子平面中运动,故能导电;②该晶胞体对角线应该是5个C原子无隙并置,则体对角线长为8a,该晶胞中含8个C原子,列式为(8×4/3πa3)/ (8a/ ![]() )3 =34%。
)3 =34%。

 阅读快车系列答案
阅读快车系列答案