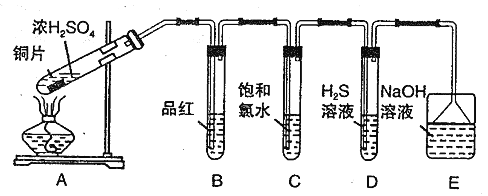
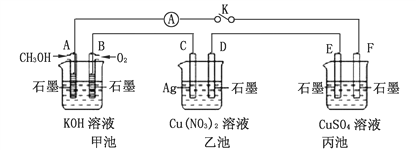
题目内容
【题目】现代传感技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验 (装置如图1所示),并用中和滴定实验测定所得氨水的浓度。
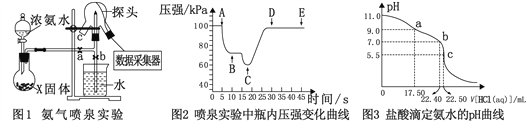
Ⅰ. 用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)制取氨气。烧瓶中X固体可以是_______________。
(2)关闭a,将吸有2 mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。则AB段压强变化的原因是__________。
Ⅱ. 室温下,用盐酸滴定得到的氨水,测定氨水的浓度。
(3)从三颈瓶中用______________(填仪器名称)量取25.00 mL氨水至锥形瓶中,用0.050 mol·L-1 盐酸滴定。用pH计采集数据、电脑绘制滴定曲线(图3)。则:
①该滴定的终点为_____________(填“a”、“b”或“c”);
②b点对应的溶液中,c(NH4+) _______ c(Cl-) (填“>”、“<”或“=”);
③据图,计算氨水的浓度为___________。
(4)该滴定实验中,若酸式滴定管未用盐酸润洗会导致测得氨水的浓度____________。
【答案】 CaO(或NaOH等) NH3溶于水,使瓶内压强减小 碱式滴定管 c = 4.5×10-2 mol·L-1 偏高(或“偏大”)
【解析】本题考查实验方案设计与评价,(1)根据图1制取氨气的装置图,分液漏斗中加入的是浓氨水,利用浓氨水受热易分解,即烧瓶中加入的固体物质为CaO或NaOH固体;(2)根据图2,AB段的压强减小,以及操作步骤,压强减小是因为NH3极易溶于水,使三颈烧瓶中压强减小;①滴定终点,应是恰好反应,两者恰好完全反应后溶质为NH4Cl,NH4Cl溶液显酸性,即c点表示滴定终点;②b点时pH=7,根据电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-),pH=7时c(H+)=c(OH-),即c(NH4+)=c(Cl-);③根据c点,两种溶液恰好完全反应,即c(NH3·H2O)=c(HCl)×V(HCl)/V(NH3·H2O)=22.50×10-3×0.050/25.00×10-3mol·L-1=0.045mol·L-1;(4)根据(3)③的表达式,酸式滴定管未用盐酸润洗,盐酸的浓度偏低,消耗盐酸的体积偏大,即所测氨水的浓度偏高。

【题目】某兴趣小组用铝箔制备Al2O3、AlCl3·6H2O及明矾大晶体,具体流程如下:

已知:AlCl3·6H2O易溶于水、乙醇及乙醚;明矾在水中的溶解度如下表。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 |
溶解度/g | 3.00 | 3.99 | 5.90 | 8.39 | 11.7 | 24.8 | 71.0 | 109 |
请回答:
(1)步骤Ⅰ中的化学方程式_________;步骤Ⅱ中生成Al(OH)3的离子方程式___________。
(2)步骤Ⅲ,下列操作合理的是____________。
A.坩埚洗净后,无需擦干,即可加入Al(OH)3灼烧
B.为了得到纯Al2O3,需灼烧至恒重
C.若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D.坩埚取下后放在石棉网上冷却待用
E.为确保称量准确,灼烧后应趁热称重
(3)步骤Ⅳ,选出在培养规则明矾大晶体过程中合理的操作并排序_______________。
①迅速降至室温 ②用玻璃棒摩擦器壁 ③配制90℃的明矾饱和溶液 ④自然冷却至室温 ⑤选规则明矾小晶体并悬挂在溶液中央 ⑥配制高于室温10-20℃的明矾饱和溶液
(4)由溶液A制备AlCl3·6H2O的装置如下图:

①通入HCl的作用是抑制AlCl3水解和________________________。
②步骤Ⅴ,抽滤时,用玻璃纤维替代滤纸的理由是_____;洗涤时,合适的洗涤剂是_____。
③步骤Ⅵ,为得到纯净的AlCl3·6H2O,宜采用的干燥方式是______________。