题目内容
7.已知反应8NH3+3Cl2═6NH4Cl+N2在常温下就能迅速进行.下列叙述错误的是( )| A. | 该反应是置换反应 | |
| B. | 氧化剂与还原剂的物质的量之比为3:2 | |
| C. | 氧化产物与还原产物的物质的量之比为6:1 | |
| D. | 被氧化的氨与未被氧化的氨的质量之比为1:3 |
分析 反应3Cl2+8NH3═N2+6NH4Cl中,Cl元素化合价降低,被还原,Cl2为氧化剂,6NH4Cl为还原产物,N元素化合价升高,被氧化,NH3为还原剂,N2为氧化产物,以此解答.
解答 解:A.该反应为单质和化合物生成另一单质和化合物,所以为置换反应,故A正确;
B.Cl元素化合价降低,则3Cl2为氧化剂,氮元素化合价升高,则2NH3为还原剂,所以氧化剂与还原剂的物质的量之比为3:2,故B正确;
C.Cl元素化合价降低,被还原,则6NH4Cl为还原产物,氮元素化合价升高,被氧化,则N2为氧化产物,所以氧化产物与还原产物的物质的量之比为1:6,故C错误;
D.由方程式可知,当有8molNH3参加反应,有2mol被氧化,6mol未被氧化,所以被氧化的氨与未被氧化的氨的质量之比为1:3,故D正确.
故选C.
点评 本题考查氯气的性质,侧重于化学与生活、生产的联系以及氧化还原反应的考查,注意从元素化合价的角度解答该题,难度不大.

练习册系列答案
相关题目
17.实验室配制500mL浓度为2mol/L的NaOH溶液.选用容量瓶的规格和所需NaOH的质量分别为( )
| A. | 100 ml 容量瓶、40 g | B. | 500 ml 容量瓶、40 g | ||
| C. | 100 ml 容量瓶、80 g | D. | 500 ml 容量瓶、80 g |
18.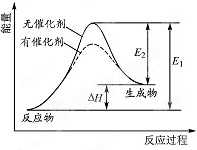 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 催化剂能改变反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
2.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:
Ⅰ、向粗盐水中加入过量BaCl2溶液,操作X;
Ⅱ、向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ、滤液用盐酸调节pH,获得第一次精制盐水.
(1)操作X使用的主要仪器为:漏斗、烧杯、玻璃棒.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
①过程Ⅰ选用BaCl2而不选用CaCl2的原因为BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全.
②过程Ⅱ之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,检验Ba2+的操作是取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+.
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去NH4+的离子方程式是3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O.
②实验室从水溶液分离出I2的操作名称为萃取.
③过程Ⅵ中,产品NaOH在电解槽的阴极区生成(填“阳极”或“阴极”),该电解槽为阳离子交换膜电解槽(填“阳”或“阴”).
Ⅰ、向粗盐水中加入过量BaCl2溶液,操作X;
Ⅱ、向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ、滤液用盐酸调节pH,获得第一次精制盐水.
(1)操作X使用的主要仪器为:漏斗、烧杯、玻璃棒.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅱ之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,检验Ba2+的操作是取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+.
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去NH4+的离子方程式是3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O.
②实验室从水溶液分离出I2的操作名称为萃取.
③过程Ⅵ中,产品NaOH在电解槽的阴极区生成(填“阳极”或“阴极”),该电解槽为阳离子交换膜电解槽(填“阳”或“阴”).
12.下列判断正确的是( )
| A. | 电负性:O>F | B. | 第一电离能:K>Na | ||
| C. | 未成对电子数:N>C | D. | o-键数:C2H2>CH4 |
19.2008年9月25日晚9时10分,我国“神舟七号”载人飞船顺利升入太空.此次火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4═3N2↑+4H2O↑+2CO2↑,下列叙述错误的是( )
| A. | 此反应是氧化还原反应 | |
| B. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| C. | 在反应中N2O4做还原剂 | |
| D. | R的分子式为C2H8N2 |
17.胡椒粉是植物挥发油的成分之一.它的结构式为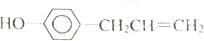 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )
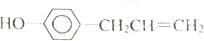 ,下列叙述中不正确的是( )
,下列叙述中不正确的是( )| A. | 1mol胡椒粉最多可与4mol氢气发生反应 | |
| B. | 1mol胡椒粉最多可与4mol溴发生反应 | |
| C. | 胡椒粉能发生加聚反应,且能与氢氧化钠溶液反应 | |
| D. | 胡椒粉分子中所有碳原子可能在同一平面上 |
