题目内容
18.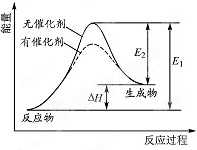 某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(E1表示正反应的活化能.E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 催化剂能改变反应的焓变 | |
| D. | 逆反应的活化能大于正反应的活化能 |
分析 A、依据图象中反应物和生成物能量的大小比较判断;
B、催化剂改变化学反应速率是降低了反应的活化能;
C、催化剂不能改变反应物和生成物的总能量;
D、正反应的活化能为E1,逆反应的活化能为E2,据图判断.
解答 解:A、图象中反应物能量低于生成物能量,故反应是吸热反应,故A错误;
B、催化剂能改变化学反应速率是因为催化剂参与了化学反应,改变了反应路径,降低了反应的活化能,从而使活化分子数和活化分子百分数增多,反应速率加快,故B正确;
C、反应的焓变取决于反应物和生成物的总能量,而催化剂不能改变反应物和生成物的总能量,故催化剂不能改变反应的焓变,故C错误;
D、正反应的活化能为E1,逆反应的活化能为E2,根据图象可知逆反应的活化能E2小于正反应的活化能E1,故D错误;
故选B.
点评 本题考查了化学反应的能量变化分析,催化剂的作用实质,图象识别和理解含义是解题关键.

练习册系列答案
相关题目
1.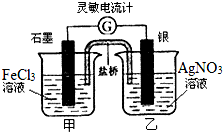 控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( )
控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( )
 控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( )
控制适合的条件,将反应Fe3++Ag?Fe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( )| A. | 在外电路中,电子从石墨电极流向银电极 | |
| B. | 盐桥中的K+移向乙烧杯 | |
| C. | 一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转 | |
| D. | 电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转 |
9.把m mol C2H4和n mol氢气混合于密闭容器中,在适当的条件下生成了p mol C2H6,若将所得的混合气体完全燃烧生成二氧化碳和水,则需氧气( )
| A. | 3.5p mol | B. | (3m+n/2)mol | C. | (3m+n)mol | D. | (3m+n/2-3 p)mol |
6.下列各组物质中,按单质、化合物、混合物顺序排列的是( )
| A. | 铁、四氧化三铁、冰水混合物 | B. | 金属钙、氧化钙、石灰水 | ||
| C. | 水银、空气、干冰 | D. | 二氧化硫、水蒸气、天然气 |
13.下列做法不能起防锈作用的是( )
| A. | 保留铁制品上的铁锈 | B. | 在铁制品表面镀锌 | ||
| C. | 在金属机械上涂油 | D. | 在盆、缸子的表面刷搪瓷 |
7.已知反应8NH3+3Cl2═6NH4Cl+N2在常温下就能迅速进行.下列叙述错误的是( )
| A. | 该反应是置换反应 | |
| B. | 氧化剂与还原剂的物质的量之比为3:2 | |
| C. | 氧化产物与还原产物的物质的量之比为6:1 | |
| D. | 被氧化的氨与未被氧化的氨的质量之比为1:3 |
8.A、B、C、D、E是同周期的五种主族元素.A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A;C和D的最高价氧化物对应的水化物均呈酸性,且酸性C>D,E是这五种元素中原子半径最小的元素,它们的原子序数由小到大的顺序是( )
| A. | A<B<C<D<E | B. | C<D<A<B<E | C. | B<A<D<C<E | D. | E<C<D<B<A |