题目内容
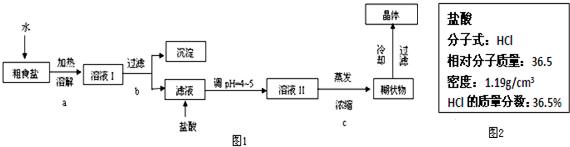
2.制烧碱所用盐水需两次精制.第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、SO42-等离子,过程如下:Ⅰ、向粗盐水中加入过量BaCl2溶液,操作X;
Ⅱ、向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ、滤液用盐酸调节pH,获得第一次精制盐水.
(1)操作X使用的主要仪器为:漏斗、烧杯、玻璃棒.
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表,请依据表中数据解释下列问题:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅱ之后检测Ca2+、Mg2+及过量Ba2+是否除尽时,只需检测Ba2+即可,检验Ba2+的操作是取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+.
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去NH4+的离子方程式是3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O.
②实验室从水溶液分离出I2的操作名称为萃取.
③过程Ⅵ中,产品NaOH在电解槽的阴极区生成(填“阳极”或“阴极”),该电解槽为阳离子交换膜电解槽(填“阳”或“阴”).
分析 (1)向粗盐水中加入过量BaCl2溶液可生成硫酸钡沉淀,分离沉淀应过滤;
(2)①根据表中数据分析BaSO4与CaSO4的溶解度大小,溶解度越小,沉淀越完全;
②可用硫酸钠检验是否含有钡离子;
(3)①次氯酸根离子具有强氧化性,能够氧化铵根离子生成氮气;
②可用萃取的方法分离碘;
③根据电解原理及水的电离平衡H2O?H++OH-进行分析在电解槽的阴极区生成NaOH原理以及判断此交换膜.
解答 解:(1)向粗盐水中加入过量BaCl2溶液,硫酸根离子与氯化钡溶液反应生成硫酸钡沉淀,分离沉淀和溶液,可用过滤的方法,用到的玻璃仪器有漏斗、烧杯、玻璃棒,故答案为:漏斗、烧杯、玻璃棒;
(2)①硫酸钡的溶度积为2.4×10-4,硫酸钙的溶度积为2.6×10-2,显然硫酸钙的溶度积大于硫酸钡,即BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完,
故答案为:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全;
②根据步骤数据可知,在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,则说明Mg2+ 和Ca2+也沉淀完全,可取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+,
故答案为:取少量清液放置于试管中,先加入盐酸,再加入硫酸钠溶液,若无白色沉淀,则可证明溶液无Ba2+;
(3)①过程Ⅳ加入次氯酸钠,次氯酸根离子能够氧化NH4+,可生成氮气,反应的离子方程式为3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O,
故答案为:3ClO-+2NH4+=3Cl-+N2↑+2H++3H2O;
②碘易溶于四氯化碳等有机溶剂,可用萃取的方法分离,故答案为:萃取;
③电解过程中,H+在阴极上得电子变成H2逸出,使H2O?H++OH-电离平衡向右移动,OH-在阴极区浓度增大,Na+向阴极区移动,最后NaOH在阴极区生成,故此交换膜为阳离子交换膜,故答案为:阴极;阳.
点评 本题考查了粗盐的提纯、难溶电解质的沉淀平衡及转化、电解原理、离子方程式的书写等知识,题目难度中等,试题涉及的题量较大,知识点较多,注意掌握粗盐的提纯方法、物质的分离与提纯原则,明确电解原理及应用方法,能够正确书写离子方程式.

| A. | 保留铁制品上的铁锈 | B. | 在铁制品表面镀锌 | ||
| C. | 在金属机械上涂油 | D. | 在盆、缸子的表面刷搪瓷 |
| A. | 该反应是置换反应 | |
| B. | 氧化剂与还原剂的物质的量之比为3:2 | |
| C. | 氧化产物与还原产物的物质的量之比为6:1 | |
| D. | 被氧化的氨与未被氧化的氨的质量之比为1:3 |
| A. | ①②④ | B. | ②④⑤ | C. | ③⑤⑥ | D. | ①②⑤ |
| A. | 丙烷和丁烷 | B. | 乙烷和丙烷 | C. | 乙烷和丁烷 | D. | 戊烷和己烷 |