题目内容
12.下列判断正确的是( )| A. | 电负性:O>F | B. | 第一电离能:K>Na | ||
| C. | 未成对电子数:N>C | D. | o-键数:C2H2>CH4 |
分析 A、得电子能力越强,电负性越大;
B、同一主族中,元素的第一电离能随着原子序数的增大而减小;
C、根据原子轨道上电子的排布来确定未成对电子数;
D、根据无论单键、双键、还是叁键都含有1个o-键判断.
解答 解:A、得电子能力O<F,所以元素的电负性O<F,故A错误;
B、同一主族中,元素的第一电离能随着原子序数的增大而减小,所以第一电离能:Na>K,故B错误;
C、C的电子排布式:1s22s22p2,N的电子排布式:1s22s22p3,所以C、N原子的未成对电子数分别为2、3,即原子的未成对电子数:N>C,故C正确;
D、因为无论单键、双键、还是叁键都含有1个o-键,所以C2H2含有3个o-键,CH4含有4个o-键,即o-键数:C2H2<CH4,故D错误.
故选C.
点评 本题考查元素及其对应原子、化合物的性质的递变规律,题目难度不大,注意元素的金属性、非金属性与元素性质的递变规律,侧重原子结构及性质的考查.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.已知反应8NH3+3Cl2═6NH4Cl+N2在常温下就能迅速进行.下列叙述错误的是( )
| A. | 该反应是置换反应 | |
| B. | 氧化剂与还原剂的物质的量之比为3:2 | |
| C. | 氧化产物与还原产物的物质的量之比为6:1 | |
| D. | 被氧化的氨与未被氧化的氨的质量之比为1:3 |
4.下列说法错误的是( )
| A. | 烧碱是强电解质,在水溶液中完全电离 | |
| B. | 将水加热,水的电离平衡向正反应方向移动,Kw变大 | |
| C. | 向溶液中加酸、加碱都能抑制水的电离 | |
| D. | 根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
1.下列说法正确的是( )
| A. | 金属元素不能得电子,不显负价,故金属元素不能形成阴离子 | |
| B. | P,S,Cl元素最高价依次升高 | |
| C. | B,C,N,O,F原子半径依次增大 | |
| D. | Li,Na,K,Rb的氧化物对应水化物的碱性依次减弱 |
2.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | C. | B的物质的量浓度 | D. | 物质A的质量 |
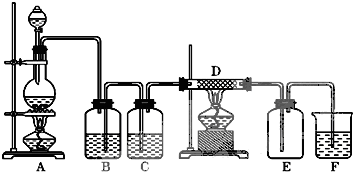
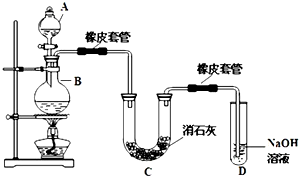 瑞典化学家舍勒在研究软锰矿(主要成份是MnO2 )的过程中,将它与浓盐酸混合物加热,产生了一种黄绿色、刺激性提心气味的气体----氯气.某学生使用这一原理设计如下图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成份是MnO2 )的过程中,将它与浓盐酸混合物加热,产生了一种黄绿色、刺激性提心气味的气体----氯气.某学生使用这一原理设计如下图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: