题目内容
15.将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是( )| A. | 过氧化氢 | B. | 氯水 | C. | 硝酸锌 | D. | 氯化铜 |
分析 铁屑溶于过量盐酸后生成亚铁离子,加氧化物物质过氧化氢、氯气、硝酸盐等均可氧化亚铁离子生成铁离子,以此来解答.
解答 解:铁屑溶于过量盐酸后生成亚铁离子,
A.过氧化氢可氧化亚铁离子生成铁离子,故A不选;
B.氯水可氧化亚铁离子生成铁离子,故B不选;
C.硝酸锌在酸性溶液中具有强氧化性,可氧化亚铁离子生成铁离子,故C不选;
D.亚铁离子与氯化铜不反应,不会有三价铁生成,故D选;
故选D.
点评 本题考查金属及化合物的性质,为高频考点,把握物质的性质、氧化还原反应为解答的关键,选项C为解答的难点,题目难度不大.

练习册系列答案
相关题目
6.下列各选项中的反应①与反应 ②能用同一离子方程式表示的是( )
| 序号 | 反应① | 反应② |
| A | NaOH与HCl反应 | Mg(OH)2与HNO3反应 |
| B | 向BaCl2溶液中滴加稀H2SO4 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| C | Cl2通入NaOH溶液中 | Cl2通入澄清石灰水中 |
| D | Fe与HCl反应 | Fe与CH3COOH反应 |
| A. | A | B. | B | C. | C | D. | D |
3.碱式碳酸钴[Cox(OH)y(CO3)z]常用作电子材料、磁性材料的添加剂,受热时可分解生成三种氧化物.为了确定其组成,某化学兴趣小组同学设计了如图1所示的装置进行实验.
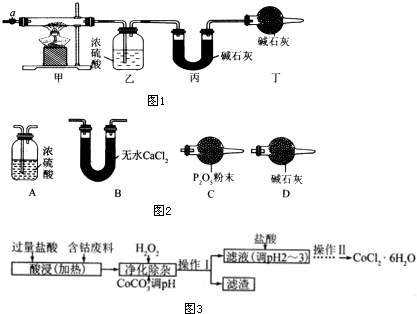
(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
则该碱式碳酸钴的化学式为Co2(OH)4(CO3)2.
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
①净化除杂时,加入 H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.

(1)请完成下列实验步骤:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,并检验装置气密性;
③加热甲中玻璃管,当乙装置中不再有气泡产生(填实验现象),停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算.
(2)步骤④中缓缓通人空气数分钟的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(3)某同学认为上述实验装置中存在一个明显缺陷,为解决这一问题,可选用图2装置中的D(填字母)连接在活塞a前(填装置连接位置).
(4)若按正确装置进行实验,测得如下数据.
| 乙装置的质量/g | 丙装置的质量/g | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |
(5)含有Co(AlO2)2的玻璃常用作实验室观察钾元素的焰色反应,该玻璃的颜色为蓝色.
(6)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如图3:
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3 调pH为5.2~7.6,则操作1获得的滤渣成分为Fe(OH)3和Al(OH)3.
③加盐酸调整pH为2~3的目的为抑制CoCl2的水解.
④操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
10.某元素X的最高价氧化物的化学式为X2O5,则它的气态氢化物化学式为( )
| A. | HX | B. | H2X | C. | XH3 | D. | XH5 |
7.实验测得CO2为共价化合物,两个C=O键间的夹角为180°,以下判断正确的是( )
| A. | 由极性键构成的极性分子 | B. | 由极性键构成的非极性分子 | ||
| C. | 由非极性键构成的极性分子 | D. | CO2中C采取sp2杂化 |
4.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 强氧化性物质可以用来杀菌消毒 | ClO2可用于自来水消毒 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硫酸,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 较强的酸可以制取较弱的酸 | 硫化氢通入硫酸铜溶液中不能反应 |
| A. | A | B. | B | C. | C | D. | D |
5.已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是( )
| A. | 若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 | |
| B. | 若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |