题目内容
7.实验测得CO2为共价化合物,两个C=O键间的夹角为180°,以下判断正确的是( )| A. | 由极性键构成的极性分子 | B. | 由极性键构成的非极性分子 | ||
| C. | 由非极性键构成的极性分子 | D. | CO2中C采取sp2杂化 |
分析 共价化合物中,不同元素原子之间形成的化学键为极性键,同种元素原子之间形成的化学键为非极性键;正电荷中心与负电荷的中心重合为非极性分子,不重合为极性分子,据此判断.
解答 解:CO2中C-O键是不同元素形成的共价键,为极性键,CO2中C原子的价层电子对数=2+$\frac{1}{2}$(4-×2)=2,为sp杂化,为直线形分子,分子是对称的,正电荷中心与负电荷的中心重合,CO2属于非极性分子,故CO2由极性键形成的非极性分子.
故选B.
点评 本题考查化学键、分子极性判断、杂化理论的应用,题目比较基础,注意基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.某同学取一定量某工厂所排废水试样,进行如下实验:
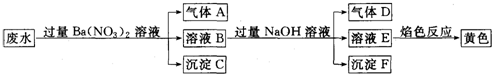
已知废水试样中可能含有下表离子中若干种.
下列判断不正确的是( )
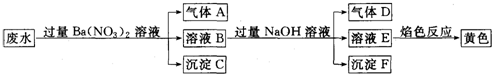
已知废水试样中可能含有下表离子中若干种.
| 阳离子 | Ba2+、K+、NH4+、Fe2+、Fe3+、X |
| 阴离子 | CO32-、SO32-、NO3-、Y |
| A. | 离子X是H+,离子Y是SO42- | |
| B. | 不能确定NO3-是否存在与废水中 | |
| C. | 沉淀C是纯净物 | |
| D. | 废水中一定存在Fe2+、NH4+,可能存在K+ |
18.不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是( )
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | NH3 | CaCl2 |
| ② | CO2 | SO2 | 石灰水 |
| ③ | NO2 | SO2 | BaCl2 |
| ④ | HCl | CO2 | 石灰水 |
| A. | ②③④ | B. | ①②③ | C. | ①③④ | D. | 全部 |
15.将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是( )
| A. | 过氧化氢 | B. | 氯水 | C. | 硝酸锌 | D. | 氯化铜 |
12.从实验测得不同物质中氧氧之间的键长和键能的数据:
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x;该规律性是( )
| O-O键 数据 | O22- | O2- | O2 | O2+ |
| 键长(10-12 m) | 149 | 128 | 121 | 112 |
| 键能(kJ•mol-1) | x | y | z=494 | w=628 |
| A. | 成键的电子数越多,键能越大 | B. | 键长越长,键能越小 | ||
| C. | 成键所用的电子数越少,键能越大 | D. | 成键时电子对越偏移,键能越大 |
19.在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
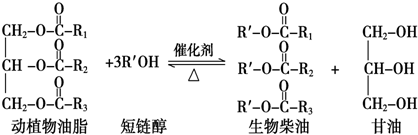
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 生物柴油由可再生资源制得 | B. | 生物柴油是不同酯组成的混合物 | ||
| C. | 动植物油脂是高分子化合物 | D. | “地沟油”可用于制备生物柴油 |
17.下列关于煤、天然气、石油等资源的说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 液化石油气和天然气的主要成分都是碳氢化合物 | |
| C. | 石油裂化得到的汽油是纯净物 | |
| D. | 煤的气化和石油的分馏都是物理变化 |