题目内容
11.实验过程中下列操作正确的是( )| A. | 给盛有2/3体积液体的试管加热 | |
| B. | CuSO4溶于水,可将含有CuSO4的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 实验时将剩余的钠放回原试剂瓶 |
分析 A.加热试管内液体时,液体体积不超过试管的三分之一;
B.硫酸铜属于重金属盐,能污染土壤和地下水;
C.蒸发氯化钠溶液时,应该将蒸发皿中溶液蒸到含有部分水时停止加热,利用余热蒸干;
D.钠极易和氧气、水反应,剩余的钠要放回原瓶.
解答 解:A.加热试管内液体时,液体体积不超过试管的三分之一,否则加热时易溅出而产生安全事故,故A错误;
B.硫酸铜属于重金属盐,能污染土壤和地下水,所以硫酸铜废液应该回收处理,故B错误;
C.蒸发方法使NaCl从溶液中析出时,蒸发时待蒸发皿中出现较多量固体时停止加热,若水分全部蒸干,固体会受热不均向外迸溅,所以利用余热蒸干,故C错误;
D.钠极易和氧气、水反应,剩余的钠要放回原瓶,不能随便丢弃,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作及药品的取用,明确实验操作规范性及实验室安全管理是解本题关键,易错选项是D.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
5.在0.5LNaCl溶液中含有58.5gNaCl,该溶液中溶质的物质的量浓度为( )
| A. | 2.0mol/L | B. | 1.0mol/L | C. | 0.5mol/L | D. | 0.2mol/L |
3.下列说法中正确的是( )
| A. | 淀粉和纤维素都属于纯净物 | |
| B. | 油脂是含热能很高的营养物质 | |
| C. | 人体摄入的微量元素越多越有利于健康 | |
| D. | 棉花、人造丝、蚕丝的主要成分都属于蛋白质 |
20.与50mL 0.1molL-1 Na2CO3 溶液中 Na+ 的物质的量浓度相同的溶液是( )
| A. | 50mL 0.2mol•L-1 的NaCl溶液 | |
| B. | 100mL 0.05mol•L-1 的NaCl溶液 | |
| C. | 25mL 0.2mol•L-1 的Na2SO4溶液 | |
| D. | 1.06g Na2CO3固体溶于水配成 100mL溶液 |
1.下列化学用语描述中正确的是( )
| A. | 含18个中子的氯原子的核素符号:1735Cl | |
| B. | 比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | |
| C. | HCO−3的电离方程式为:HCO−3+H2O?CO2−3+H3O+ | |
| D. | 次氯酸的结构式:H-Cl-O |
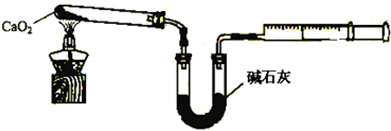
 .
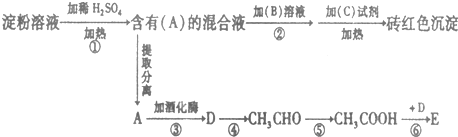
.
 ;
;