题目内容
2.过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面.工业生产过程如下:①在NH4Cl溶液中加入Ca(OH)2;
②不断搅拌的同时加入30% H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2.
完成下列填空
(1)第②步反应的化学方程式为CaCl2+H2O2+8H2O+2NH3=CaO2•8H2O↓+2NH4Cl.
(2)可循环使用的物质是NH4Cl.
工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产,这是因为Ca(OH)2价格低,H2O2价格较高且易分解,碱性条件下抑制CaO2•8H2O溶解.
(3)检验CaO2•8H2O是否洗净的方法是取洗涤液少许,向其中加入AgNO3溶液,再滴加几滴稀硝酸,若无白色沉淀产生,就证明洗涤干净,否则没有洗涤干净.
(4)CaO2•8H2O加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是抑制过氧化钙分解、防止过氧化钙与二氧化碳反应.
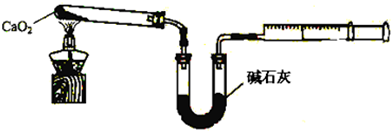
(5)已知CaO2在350℃迅速分解生成CaO和O2.如图是实验室测定产品中CaO2含量的装置(夹持装置省略).
若所取产品质量是m g,测得气体体积为V mL(已换算成标准状况),则产品中CaO2的质量分数为$\frac{9V}{1400m}$(用字母表示).过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量、完全分解后剩余固体的质量
分析 (1)第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵,氢氧化钙价格低,H2O2价格较高且易分解;
(3)实验室用硝酸酸化的硝酸银溶液检验;
(4)CaO2能和水反应,氧气能抑制CaO2分解;
(5)根据过氧化钙和氧气之间的关系式计算;
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量.
解答 解:(1)第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵,反应方程式为CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
故答案为:CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵,所以可以循环使用的物质是NH4Cl;
H2O2价格较高且易分解,碱性条件下抑制CaO2•8H2O溶解,所以工业上常采用Ca(OH)2过量而不是H2O2过量的方式来生产;
故答案为:NH4Cl;Ca(OH)2价格低,H2O2价格较高且易分解,碱性条件下抑制CaO2•8H2O溶解;
(3)实验室用硝酸酸化的硝酸银溶液检验,如果沉淀没有洗涤干净,向洗涤液中加入硝酸酸化的硝酸银溶液应该有白色沉淀,其检验方法是:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净,
故答案为:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净;
(4)CaO2能和水反应生成氢氧化钙和氧气,CaO2在350℃迅速分解生成CaO和O2,所以通入氧气能抑制超氧化钙分解;
故答案为:防止过氧化钙和水反应;防止过氧化钙分解;
(5)设超氧化钙质量为x,
2CaO2 $\frac{\underline{\;350°C\;}}{\;}$2CaO+O2↑
144g 22.4L
x 10-3VL
144g:22.4L=x:10-3VL
x=$\frac{144g×1{0}^{-3}VL}{22.4L}$=$\frac{144V}{22400}$g=$\frac{9V}{1400}$g,
其质量分数=$\frac{\frac{9V}{1400}g}{mg}$×100%=$\frac{9V}{1400m}$×100%,
过氧化钙的含量也可用重量法测定,需要测定的物理量有样品质量和反应后固体质量,
故答案为:$\frac{9V}{1400m}$×100%;样品质量和反应后固体质量.
点评 本题考查制备实验方案评价,为高频考点,侧重考查离子检验、化学反应方程式的书写、物质含量测定等知识点,明确实验原理及物质性质是解本题关键,难点是题给信息的挖掘和运用,题目难度中等.

| A. | $\frac{c(O{H}^{-})•c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | pH | ||
| C. | NH3•H2O 的电离度 | D. | n(OH-) |
| A. | 75% | B. | 25% | C. | 37.5% | D. | 81% |
| A. | Na2CO3(s) | B. | 3.0mol/LHNO3 | C. | CH3COONa(aq) | D. | CuSO4(aq) |
| A. | 给盛有2/3体积液体的试管加热 | |
| B. | CuSO4溶于水,可将含有CuSO4的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 实验时将剩余的钠放回原试剂瓶 |
| A. | 1000 mL,106 gNa2CO3 | B. | 950 mL,101.8 g Na2CO3 | ||
| C. | 500 mL,286 g Na2CO3?10H2O | D. | 1000 mL,101.8 g Na2CO3 |