题目内容
1.下列化学用语描述中正确的是( )| A. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl | |
| B. | 比例模型 可以表示CO2 分子或SiO2分子 可以表示CO2 分子或SiO2分子 | |
| C. | HCO${\;}_{3}^{-}$的电离方程式为:HCO${\;}_{3}^{-}$+H2O?CO${\;}_{3}^{2-}$+H3O+ | |
| D. | 次氯酸的结构式:H-Cl-O |
分析 A.原子符号ZAX,左下角Z代表质子数,左上角A为质量数,X代表元素符号,其中质量数=质子数+中子数;
B.CO2 为分子晶体,可以利用 表示,SiO2为原子晶体;
表示,SiO2为原子晶体;
C.碳酸氢根电离生成碳酸根和氢离子;
D.次氯酸中O分别与H和Cl形成共价键.
解答 解:A.含18个中子的氯原子,其质量数为17+18=35,故该核素的符号为1735Cl,故A错误;
B.CO2 为分子晶体,可以利用 表示,SiO2为原子晶体,不能用此表示,故B错误;
表示,SiO2为原子晶体,不能用此表示,故B错误;
C.碳酸氢根电离生成碳酸根和氢离子,题中H3O+为水合氢离子,故C正确;
D.次氯酸中O最外层2个单电子,分别与H和Cl形成共价键,即结构式为H-O-Cl,故D错误,
故选C.
点评 本题考查常用化学用语,难度中等,旨在考查学生对基础知识的理解掌握,注意D选项从原子的外层电子结构分析.

练习册系列答案
相关题目
11.实验过程中下列操作正确的是( )
| A. | 给盛有2/3体积液体的试管加热 | |
| B. | CuSO4溶于水,可将含有CuSO4的废液倒入水槽中,再用水冲入下水道 | |
| C. | 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 | |
| D. | 实验时将剩余的钠放回原试剂瓶 |
12.某实验小组需要1mol/L的Na2CO3溶液960mL,欲配制所需溶液时应选用容量瓶的规格和称量的样品质量分别为( )
| A. | 1000 mL,106 gNa2CO3 | B. | 950 mL,101.8 g Na2CO3 | ||
| C. | 500 mL,286 g Na2CO3?10H2O | D. | 1000 mL,101.8 g Na2CO3 |
9.许多氧化物在一定条件下都能与Na2O2反应,且反应极有规律,如,Na2O2+SO2═Na2SO4 2Na2O2+2SO3═2Na2SO4+O2,据此你认为下列反应方程式正确的是( )
| A. | 2Na2O2+2N2O3═4NaNO2+O2 | B. | Na2O2+2NO2═2NaNO2+O2 | ||
| C. | Na2O2+N2O5═2 NaNO3+O2 | D. | 2Na2O2+2Mn2O7═4NaMnO4+O2 |
16.向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,向过滤后的滤液中滴入KSCN溶液,无明显现象,由此得出的正确结论是( )
| A. | 白色沉淀是BaSO3 | B. | 白色沉淀是BaSO3和BaSO4的混合物 | ||
| C. | 白色沉淀是BaSO4 | D. | FeCl3已全部被氧化为FeCl2 |
6.在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体恰好反应后,再加入足量的铁粉充分反应.所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为( )
| A. | 1.5mol/L | B. | 2mol/L | C. | 1mol/L | D. | 无法确定 |
13.某研究小组探究SO2和Fe(NO3)3溶液的反应,其反应装置如图所示:
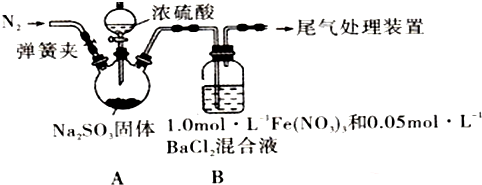
已知:l.0mol•L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)装置B中产生了白色沉淀,其成分是BaS04,说明SO2具有还原性.
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO${\;}_{3}^{-}$反应;
猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色.
【得出结论】:猜想1成立.其结论正确吗?否(填是或否).
若不正确,理由是可能SO2过量,溶解的SO2也能使KMnO4溶液褪色(正确无需回答).
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO${\;}_{3}^{-}$在不同条件下的还原产物较复杂,有时难以观察到气体产生.除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等.)
(6)在实际操作中,当SO2通入Fe(NO3)3溶液时观察到的现象;溶液由黄色变为浅绿色,接着又变为黄色,请用相关离子方程式表示其过程SO2+2Fe3++2H2O=SO42-+2Fe2++4H+、3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O.

已知:l.0mol•L-1的Fe(NO3)3溶液的pH=l,请回答下列问题:
(1)装置A中反应的化学方程式是Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O.
(2)为排除空气对实验的干扰,滴加浓硫酸之前进行的操作是关闭分液漏斗活塞,打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.
(3)装置B中产生了白色沉淀,其成分是BaS04,说明SO2具有还原性.
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO${\;}_{3}^{-}$反应;
猜想3:…
(4)甲同学从装置B中取出适量反应后的溶液,能使KMnO4溶液褪色.
【得出结论】:猜想1成立.其结论正确吗?否(填是或否).
若不正确,理由是可能SO2过量,溶解的SO2也能使KMnO4溶液褪色(正确无需回答).
(5)乙同学设计实验验证猜想2,请帮他完成下表中内容(提示:NO${\;}_{3}^{-}$在不同条件下的还原产物较复杂,有时难以观察到气体产生.除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等.)
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ①用NaNO3和盐酸配成pH=1, C(NO3-)=3mol•L-1的溶液,并替换装置B中的Fe(NO3)3溶液. ②打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹.再打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸. | 若装置B中有白色沉淀生成,猜想2成立.否则,猜想2不成立. |
10.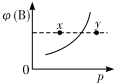 现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
 现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点的混合物中v(正)<v(逆) | D. | x点比y点的正反应速率小 |