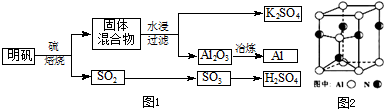
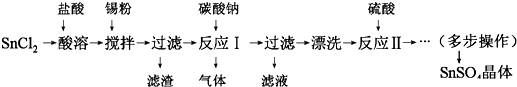
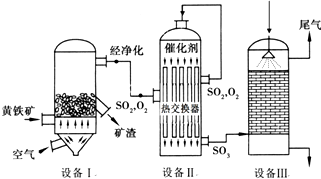
题目内容
17.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸.反应原理(如图):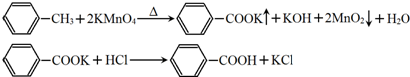
已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.
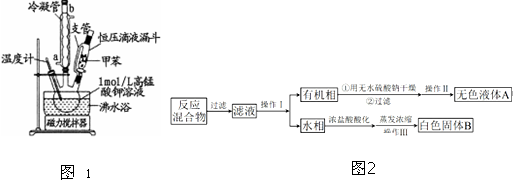
(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解,冷却结晶、过滤. | 得到白色晶体和无色溶液 | ╲ |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液. | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点. | 白色晶体在122.4℃左右时完全熔化 | 白色晶体是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
分析 (1)根据逆流的冷却的效率高的原理判断,支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等;
(2)本实验中用到的液体体积约为55mL,据此选择三颈烧瓶的规格,沸水浴加热便于控制温度和使容器受热均匀;
(3)依据流程分析混合物分离的实验方法和操作步骤;
(4)结合反应化学方程式中生成的产物和流程中分离步骤分析,白色固体B是苯甲酸与KCl的混合物;依据苯甲酸熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;先检验苯甲酸的检验再检验氯化钾的存在;
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则读取的溶液的体积小于实际用掉的溶液的体积,据此判断;根据苯甲酸纯度=$\frac{苯甲酸的质量}{样品的质量}$×100%计算纯度.
解答 解:(1)根据逆流的冷却的效率高的原理可知,进水口应在冷凝管的下方a处,支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶,
故答案为:a;平衡压强,便于甲苯顺利滴入三颈烧瓶;
(2)本实验中用到的液体体积约为55mL,所以选择100mL的三颈烧瓶,故选B,沸水浴加热便于控制温度和使容器受热均匀,
故答案为:B;便于控制温度和使容器受热均匀;
(3)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体,
故答案为:分液;蒸馏;
(4)通过测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与KCl的混合物,氯化钾可以用硝酸酸化的硝酸银溶液检验氯离子的存在;利用苯甲酸的溶解度特征在25℃和95℃时溶解度分别为0.3g和6.9g;利用不同温度下的溶解度,分离混合物,得到晶体后通过测定熔点判断是否为苯甲酸,所以实验方案及现象为:
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热,溶解,冷却结晶、过滤 | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含有Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点; | 白色晶体在122.4℃左右时完全熔化 | 白色晶体是苯甲酸 |
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则读取的溶液的体积小于实际用掉的溶液的体积,所以测定结果偏小;苯甲酸纯度=$\frac{苯甲酸的质量}{样品的质量}$×100%=$\frac{2.4×10{\;}^{-3}mol×4×122g/mol}{1.22g}$×100%=96%,
故答案为:偏小;96%.
点评 本题考查了物质性质的实验原理的分析判断,物质分离条件,试剂选择,操作步骤的理解应用,物质成分的实验设计方案、步骤、试剂,样品纯度的计算,题目难度中等.

| A. | 增大压强可提高反应速率 | B. | 升高温度可减小反应速率 | ||
| C. | 达到平衡时,v(正)=v(逆)=0 | D. | 达到平衡时,NO2转化率为100% |
甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用如图1装置制取氨气,你所选择的试剂是浓氨水与生石灰或氢氧化钠固体等.
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中. 当悬浮物较多时,停止制备.
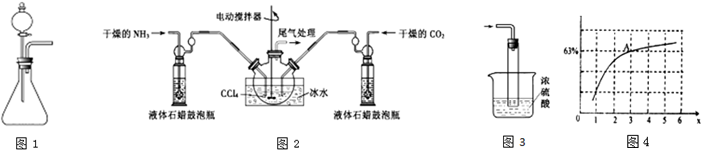
注:四氯化碳与液体石蜡均为惰性介质.
①制备氨基甲酸铵时温度不能高,该实验中控温措施有哪些搅拌、冰水浴、控制通入气体流速.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
③尾气处理装置如右图所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.782 0g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80.00%.
[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100]
(4)以NH3和CO2为原料在工业上生产尿素的原理是:2NH3(g)+CO2(g)?CO(NH2)(I)+H2O(I),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比),
如图4是氨碳比(x),$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x与CO2平衡转化率(a)的关系.
a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.,图中A点处NH3的平衡转化率为42%.
| A. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:2Fe3++Cu=2Fe+Cu2+ | |
| D. | 碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| A. | NO2 和SO2气体同时通入BaCl2溶液中 | |
| B. | SO2气体通入BaCl2溶液中 | |
| C. | SO2气体通入Ba(NO3)2溶液中 | |
| D. | SO2气体和过量NH3 同时通入BaCl2溶液中 |