题目内容
7.下列实验中不能出现沉淀现象的是( )| A. | NO2 和SO2气体同时通入BaCl2溶液中 | |
| B. | SO2气体通入BaCl2溶液中 | |
| C. | SO2气体通入Ba(NO3)2溶液中 | |
| D. | SO2气体和过量NH3 同时通入BaCl2溶液中 |
分析 A.二氧化氮与水反应生成硝酸,硝酸氧化二氧化硫生成硫酸;
B.亚硫酸的酸性弱于盐酸;
C.硝酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸;
D.SO2气体和过量NH3 在水溶液中反应生成亚硫酸氨,亚硫酸氨与氯化钡反应生成亚硫酸钡沉淀.
解答 解:A.二氧化氮与水反应生成硝酸,硝酸氧化二氧化硫生成硫酸,硫酸能够与氯化钡反应生成硫酸钡白色沉淀,故A不选;
B.亚硫酸的酸性弱于盐酸,SO2气体通入BaCl2溶液中不发生反应,得不到沉淀,故B选;
C.SO2气体通入Ba(NO3)2溶液中发生反应生成硫酸钡沉淀,故C不选;
D.SO2气体和过量NH3 同时通入BaCl2溶液中,发生反应生成亚硫酸钡沉淀,故D不选;
故选:B.
点评 本题考查了元素化合物知识,明确二氧化硫的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
17.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸.反应原理(如图):
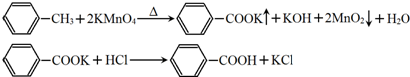
已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.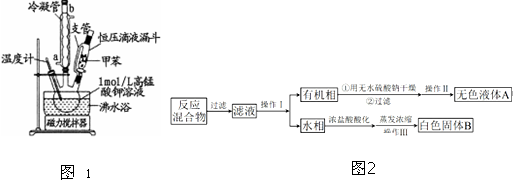
(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
【纯度测定】称取1.220g白色晶体,配成100mL甲醇溶液,取25.00mL溶液,用0.1000mol/LKOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示.
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果偏小(填“偏大”、“偏小”或“不变”).计算样品中苯甲酸纯度为96%.

已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.

(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解,冷却结晶、过滤. | 得到白色晶体和无色溶液 | ╲ |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液. | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点. | 白色晶体在122.4℃左右时完全熔化 | 白色晶体是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
18.已知乙烯能被酸性高锰酸钾溶液氧化成CO2,既可用来鉴别乙烷和乙烯,又可用来除去乙烷中混有的乙烯的方法是( )
| A. | 通入足量溴水中 | B. | 分别在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 在一定条件下通入氢气 |
15.下列关于仪器使用的说法正确的是( )
| A. | 在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 | |
| B. | 熔融纯碱、烧碱时,不能选用石英坩埚,应该选用铁坩埚 | |
| C. | 蒸发结晶实验中,蒸发皿应放在石棉网上加热 | |
| D. | 在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果 |
2.向含有n gHNO3的稀硝酸中加入m g铁粉,充分反应后铁粉、硝酸均无剩余.若HNO3只被还原为NO,则n:m不可能的为( )
| A. | 3:1 | B. | 5:1 | C. | 4:1 | D. | 9:2 |
19.按要求回答下列问题:
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是C.
A.溶液中导电粒子的数目减少
B醋酸的电离程度增大,c(H+)亦增大
C. 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变
D溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$减小
(2)常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列正确的是AD.
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(3)几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2-、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[(Mg(OH)2](填“>”、“二”或“<”).
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是C.
A.溶液中导电粒子的数目减少
B醋酸的电离程度增大,c(H+)亦增大
C. 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变
D溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$减小
(2)常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列正确的是AD.
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(3)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
16.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温才过滤 |
17.经测定乙烯的乙醇溶液中,氧的质量分数为20%,则此溶液中氢的质量分数为( )
| A. | 75% | B. | 13.6% | C. | 20% | D. | 25% |
 +2NaOH$\stackrel{醇△}{→}$
+2NaOH$\stackrel{醇△}{→}$ +2NaBr+2H2O.
+2NaBr+2H2O. .
. +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O. .
.