题目内容
8.明矾石经处理后得到明矾[KAl(SO4)2•12H2O].从明矾制备Al、K2SO4和H2SO4的工艺过程如图1所示: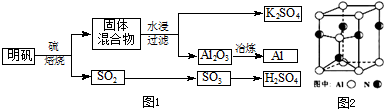
焙烧明矾的化学方程式为:4KAl(SO4)2•12H2O+3S=2K2SO4+2Al2O3+9SO2+48H2O,请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂与还原剂的物质的量之比是1:1.
(2)写出冶炼Al的化学方程式:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(3)写出明矾水溶液中离子浓度由大到小的关系:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-).
(4)Al2O3在一定条件下可制得AlN,其晶体结构如图2所示,该晶体中Al的杂化轨道方式是sp3,N原子的配位数是4
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2.请写出:
①放电时负极反应式:Al-3e-+4OH-=AlO-2+2H2O.②若将该电池充电,充电时阳极反应式为:Ni(OH)2-e-+OH-=NiO(OH)+H2O.
(6)焙烧产生的SO2可用于制硫酸.已知25℃、101kPa时:2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ/mol;H2O(g)=H2O(1)△H2=-44kJ/mol;2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H2=-545kJ/mol.则SO3(g)与H2O(l)反应的热化学方程式是:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol.焙烧948t明矾(M=474g/mol ),SO2 的利用率为96%,可生产质量分数为98%的浓硫酸432t.
分析 (1)依据化学方程式中元素化合价变化分析判断,元素化合价升高的做还原剂发生氧化反应,化合价降低做氧化剂,发生还原反应;
(2)用电解熔融的三氧化二铝制得铝;
(3)明矾是强酸弱碱盐,水解溶液呈酸性,二元微粒离子浓度>一元不水解的离子浓度>一元水解的离子浓度>显性离子>隐性离子;
(4)由图可知一个铝与4个氮原子成键,所以晶体中Al的杂化轨道方式为sp3,依据晶体晶胞结构分析,结合配位数含义可知,每个氮原子和四个铝原子相连,所以氮原子的配位数为4;
(5)①以Al和NiO(OH)为电极,铝做原电池 负极失电子发生氧化反应,NiO(OH)得到电子发生还原反应,结合原子守恒和电子守恒写出反应化学方程式;
②充电时阳极反应式是放电时正极的逆过程;
(6)依据热化学方程式和盖斯定律计算得到;依据硫元素守恒计算得到.
解答 解;(1)4KAl(SO4)2•12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应硫单质中硫元素化合价升高为+4价.硫酸根离子中硫元素化合价从+6价变化为+4价,复印纸还原剂是硫单质,而氧化剂是6mol的硫酸根离子,即3mol的4KAl(SO4)2•12H2O,所以氧化剂和还原剂的物质的量之比为1:1,故答案为:1:1;
(2)用电解熔融的三氧化二铝制得铝,方程式为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
(3)明矾是强酸弱碱盐,水解溶液呈酸性,所以离子浓度大小顺序为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-),故答案为:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-);
(4)由图可知一个铝与4个氮原子成键,所以晶体中Al的杂化轨道方式为sp3,依据晶体晶胞结构分析,结合配位数含义可知,每个氮原子和四个铝原子相连,所以氮原子的配位数为4,故答案为:sp3; 4;
(5)①以Al和NiO(OH)为电极,铝做原电池 负极失电子发生氧化反应,电极反应式为:Al-3e-+4OH-=AlO2-+2H2O;正极NiO(OH)得到电子发生还原反应,所以阳极反应为:Ni(OH)2-e-+OH-=NiO(OH)+H2O,故答案为:①Al-3e-+4OH-=AlO-2+2H2O②Ni(OH)2-e-+OH-=NiO(OH)+H2O;
(6)2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol; ①
2H2O(g)=2H2O(1)△H2=一44kJ/mol; ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol. ③
依据盖斯定律③-①-②得到:2SO3(g)+2H2O(l)=2H2SO4(l)△H=-304KJ/mol,
即反应的热化学方程式为:SO3(g)+H2O(l)=H2SO4(l)△H=-130KJ/mol;
948 t明矾生成SO2物质的量为4500mol 故生成硫酸的质量m=4500×0.96×98÷0.98=432000Kg=432t.
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130 kJ/mol;432.
点评 本题考查了氧化还原反应概念分析判断,晶体结构的理解分析,原电池反应的实质应用,热化学方程式和盖斯定律的计算,元素守恒的计算应用,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案| A. | 简单离子半径:Y>Z>W | |
| B. | 简单氢化物的热稳定性:X>Y>R | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | R的最高价氧化物对应的水化物化学式一定是HRO4 |
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | D、E形成的简单离子的还原性:E->D- | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.
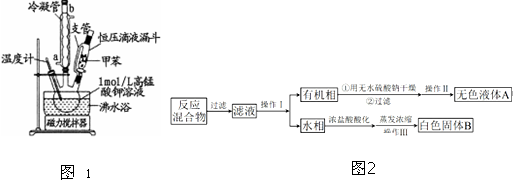
(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解,冷却结晶、过滤. | 得到白色晶体和无色溶液 | ╲ |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液. | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点. | 白色晶体在122.4℃左右时完全熔化 | 白色晶体是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
| A. | 通入足量溴水中 | B. | 分别在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 在一定条件下通入氢气 |
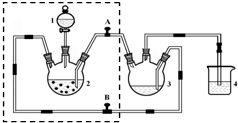 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下: 无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):
无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):