题目内容
6.下列离子方程式书写正确的是( )| A. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:2Fe3++Cu=2Fe+Cu2+ | |
| D. | 碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
分析 A.澄清石灰水中的氢氧化钙需要拆开,不能保留化学式;
B.氢氧化钡与稀硫酸反应生成硫酸钡和水,漏掉了生成水的反应;
C.铁离子与铜反应生成亚铁离子和铁离子,离子方程式两边不明显电荷守恒;
D.碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水.
解答 解:A.澄清的石灰水与稀盐酸反应生成氯化钙和水,氢氧化钙需要拆开,正确的离子方程式为:OH-+2H+=H2O,故A错误;
B.氢氧化钡溶液与稀硫酸的反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.用FeCl3溶液腐蚀印刷电路板上铜箔,二者反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故C错误;
D.碳酸钙溶于稀盐酸中生成二氧化碳气体,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | D、E形成的简单离子的还原性:E->D- | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
17.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸.反应原理(如图):
已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.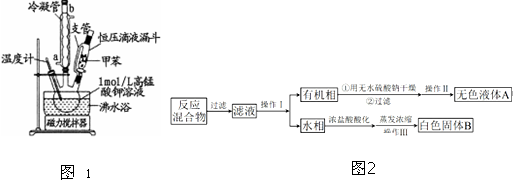
(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
【纯度测定】称取1.220g白色晶体,配成100mL甲醇溶液,取25.00mL溶液,用0.1000mol/LKOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示.
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果偏小(填“偏大”、“偏小”或“不变”).计算样品中苯甲酸纯度为96%.

已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.

(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解,冷却结晶、过滤. | 得到白色晶体和无色溶液 | ╲ |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液. | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点. | 白色晶体在122.4℃左右时完全熔化 | 白色晶体是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
14.向100mLFeCl3 溶液中通入标准状况下的H2S气体3.36L,设 H2S全部被吸收后,再加入过量的铁粉,待反应停止后,测得溶液中含有0.6mol金属阳离子,则原FeCl3溶液的物质的量浓度为( )
| A. | 5.0 m o l/L | B. | 4.0 m o l/L | C. | 4.5 m o l/L | D. | 3.0 m o l/L |
1.电化学降解NO的原理如图所示.下列说法中正确的是( )


| A. | 铅蓄电池的A极为负极,电极材料为Pb | |
| B. | 铅蓄电池工作过程中每通过电路中2mol电子则消耗1molH2SO4 | |
| C. | 该电解池的阴极反应为 2NO3-+6H2O+10e-=N2↑+12OH- | |
| D. | 若电解过程中转移5moL电子,则交换膜两侧电解液的质量变化差(△m左-△m右)为14.4g |
11.下列有关元素周期表的说法正确的是( )
| A. | 对于元素周期表和元素周期律的发现有突出贡献的科学家是阿伏加德罗 | |
| B. | 元素周期表根据相对原子质量从小到大的顺序排列 | |
| C. | 现常见的元素周期表有七个横行,分为七个周期,有18个纵行,分为16个族 | |
| D. | 每一周期都是从金属元素开始,非金属元素结束 |
18.已知乙烯能被酸性高锰酸钾溶液氧化成CO2,既可用来鉴别乙烷和乙烯,又可用来除去乙烷中混有的乙烯的方法是( )
| A. | 通入足量溴水中 | B. | 分别在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 在一定条件下通入氢气 |
15.下列关于仪器使用的说法正确的是( )
| A. | 在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 | |
| B. | 熔融纯碱、烧碱时,不能选用石英坩埚,应该选用铁坩埚 | |
| C. | 蒸发结晶实验中,蒸发皿应放在石棉网上加热 | |
| D. | 在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果 |
16.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温才过滤 |