题目内容
17.臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g).有关说法正确的是( )| A. | 增大压强可提高反应速率 | B. | 升高温度可减小反应速率 | ||
| C. | 达到平衡时,v(正)=v(逆)=0 | D. | 达到平衡时,NO2转化率为100% |
分析 A.该反应中有气体参与,增大压强能增大反应物浓度而能加快反应速率;
B.无论吸热反应还是放热反应,升高温度加快正逆反应速率;
C.可逆反应达到平衡状态时,正逆反应速率相等但不等于0;
D.该反应是可逆反应,存在化学反应限度.
解答 解:A.该反应中有气体参与,增大压强能增大反应物浓度而能加快反应速率,所以增大压强能加快反应速率,故A正确;
B.无论吸热反应还是放热反应,升高温度加快正逆反应速率,所以升高温度能加快反应速率,故B错误;
C.可逆反应达到平衡状态时,正逆反应速率相等但不等于0,反应为动态平衡状态,故C错误;
D.该反应是可逆反应,存在化学反应限度,所以反应物不能完全转化为生成物,故D错误;
故选A.
点评 本题考查化学反应速率影响因素、平衡状态特点、可逆反应特点等知识点,为高考高频点,注意温度对化学反应速率的影响适用于所有的化学反应,易错选项是B.

练习册系列答案
相关题目
8.已知X、Y、Z、W、R是原子序数依次增大的五种短周期主族元素,其中Y、R原子最外层电子数相等;X元素最低负价与W元素最高正价绝对值相等;工业上常用电解熔融氧化物的方法冶炼W单质;Z、W、R最高价氧化物对应的水化物两两反应均生成盐和水.下列说法正确的是( )
| A. | 简单离子半径:Y>Z>W | |
| B. | 简单氢化物的热稳定性:X>Y>R | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | R的最高价氧化物对应的水化物化学式一定是HRO4 |
12.下列物质属于共价化合物的是( )
| A. | H2O | B. | I2 | C. | NH4Cl | D. | CaCl2 |
2. 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
 干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )
干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )| A. | 碳为电池的正极 | |
| B. | Zn极上发生还原反应 | |
| C. | 常见锌锰干电池为二次电池 | |
| D. | 反应2NH4++2e-=2NH3↑+H2↑在负极上发生 |
6.下表为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | D、E形成的简单离子的还原性:E->D- | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
17.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸.反应原理(如图):
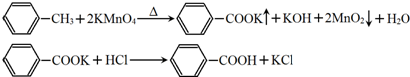
已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.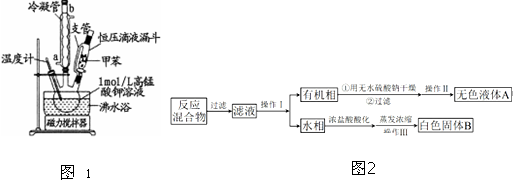
(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
【纯度测定】称取1.220g白色晶体,配成100mL甲醇溶液,取25.00mL溶液,用0.1000mol/LKOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示.
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果偏小(填“偏大”、“偏小”或“不变”).计算样品中苯甲酸纯度为96%.

已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.

(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解,冷却结晶、过滤. | 得到白色晶体和无色溶液 | ╲ |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液. | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点. | 白色晶体在122.4℃左右时完全熔化 | 白色晶体是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |