题目内容
5.硫酸亚锡(SnSO4)主要用于电镀工业的镀锡、铝合金表面氧化着色、印染工业的媒染剂、双氧水去除剂等.某研究小组设计SnSO4制备路线如图: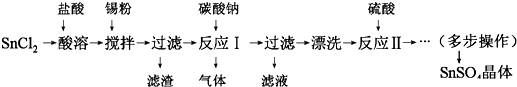
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中主要以Sn2+、Sn4+两种形式存在,碱性条件下溶液中主要以Sn(OH)42-、Sn(OH)62-两种形式存在;
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡).
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因加入盐酸,使水解平衡向左移动,抑制Sn2+水解;
(2)加入Sn粉的作用有两个:调节溶液pH,防止Sn2+被氧化;
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO,写出该反应的离子方程式Sn2++CO32-═SnO↓+CO2↑,该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净;
(4)多步操作包含的具体实验步骤的名称是:加热浓缩、冷却结晶、过滤、洗涤;
(5)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O取1.226g锡粉样品,经上述各步反应后,共用去0.1000mol/L K2Cr2O7溶液32.00mL.则该锡粉样品中锡的质量分数是93.18%.(计算结果精确至0.01%)
分析 SnCl2粉末加浓盐酸进行溶解得到酸性溶液,此时溶液中含有Sn2+、Sn4+,向其中加入Sn粉,Sn粉可以和H+发生反应,使溶液酸性减弱,调节了溶液pH值,另外Sn可以将被氧化生成的Sn4+还原成Sn2+,即防止Sn2+被氧化为Sn4+,过滤得SnCl2溶液,向其中加碳酸钠,将Sn元素以SnO形式沉淀,过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体;
(1)SnCl2在水中发生水解反应,加入HCl,可使水解平衡向逆反应方向移动,抑制Sn2+水解;
(2)由于在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化,加入Sn粉,Sn粉可以和H+发生反应,使溶液酸性减弱,调节了溶液pH,另外Sn可以将被氧化生成的Sn4+还原成Sn2+,即防止Sn2+被氧化为Sn4+;
(3)反应Ⅰ为向SnCl2溶液中加碳酸钠,得到的沉淀为SnO,反应离子方程式为:Sn2++CO32-═SnO↓+CO2↑;该沉淀经过滤后,表面附着着Cl-,要想检验滤渣是否洗涤干净,只要检验最后一次洗涤液中是否含有Cl-,若没有,则证明已经洗涤干净,否则没有洗涤干净,用AgNO3溶液检验Cl-;
(4)由溶液得到晶体的方法、步骤为:加热浓缩、冷却结晶、过滤、洗涤;
(5)①②③发生的反应分别为Sn+2HCl→SnCl2+H2↑①,SnCl2+2FeCl3=SnCl4+2FeCl2②,6FeCl2+K2Cr2O7+14HCl→6FeCl3+2KCl+2CrCl3+7H2O6Sn~K2Cr2O7③由方程式①②③得知K2Cr2O7~6FeCl2~3SnCl2~3Sn,根据转化关系进行计算.
解答 解:SnCl2粉末加浓盐酸进行溶解得到酸性溶液,此时溶液中含有Sn2+、Sn4+,向其中加入Sn粉,Sn粉可以和H+发生反应,使溶液酸性减弱,调节了溶液pH值,另外Sn可以将被氧化生成的Sn4+还原成Sn2+,即防止Sn2+被氧化为Sn4+,过滤得SnCl2溶液,向其中加碳酸钠,将Sn元素以SnO形式沉淀,过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体;
(1)SnCl2在水中发生水解反应:SnCl2+H2O═Sn(OH)Cl+HCl(可逆反应,应该用可逆号),生成难溶物Sn(OH)Cl,溶液含有杂质,若加入HCl,可使平衡向逆反应方向移动,抑制Sn2+水解;
故答案为:加入盐酸,使水解平衡向左移动,抑制Sn2+水解;
(2)由于在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化,加入Sn粉,Sn粉可以和H+发生反应,使溶液酸性减弱,调节了溶液pH,另外Sn可以将被氧化生成的Sn4+还原成Sn2+,即防止Sn2+被氧化为Sn4+;
故答案为:调节溶液pH;防止Sn2+被氧化;
(3)反应Ⅰ为向SnCl2溶液中加碳酸钠,得到的沉淀为SnO,反应离子方程式为:Sn2++CO32-═SnO↓+CO2↑;该沉淀经过滤后,表面附着着Cl-,要想检验滤渣是否洗涤干净,只要检验最后一次洗涤液中是否含有Cl-,若没有,则证明已经洗涤干净,否则没有洗涤干净,用AgNO3溶液检验Cl-,方法:取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净,
故答案为:Sn2++CO32-═SnO↓+CO2↑;取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净;
(4)反应Ⅱ已经得到SnSO4溶液,由溶液得到晶体的方法、步骤为:加热浓缩、冷却结晶、过滤、洗涤,
故答案为:加热浓缩、冷却结晶、过滤、洗涤;
(5)①②③发生的反应分别为Sn+2HCl→SnCl2+H2↑①,SnCl2+2FeCl3=SnCl4+2FeCl2②,6FeCl2+K2Cr2O7+14HCl→6FeCl3+2KCl+2CrCl3+7H2O6Sn~K2Cr2O7③由方程式①②③得知K2Cr2O7~6FeCl2~3SnCl2~3Sn,
n(Sn)=3n(K2Cr2O7)=3×0.1000mol/L×0.032L=0.0096mol,m(Sn)=n(Sn)×M(Sn)=0.0096mol×119g/mol=1.1424g,
锡粉样品中锡的质量分数=$\frac{m(Sn)}{m(样品)}$×100%=$\frac{1.1424g}{1.226g}$×100%=93.18%,
故答案为:93.18%.
点评 本题主要考查物质的分离提纯、对新信息的理解应用、测量物质的含量,注意(5)中用到多步反应得出物质量的关系,题目难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | A、B简单离子半径大小关系为B3+>A2+ | |
| B. | D、E形成的简单离子的还原性:E->D- | |
| C. | 气态氢化物的稳定性:HD<H2C | |
| D. | 最高价氧化物对应的水化物的酸性:H2CO4>HEO4 |
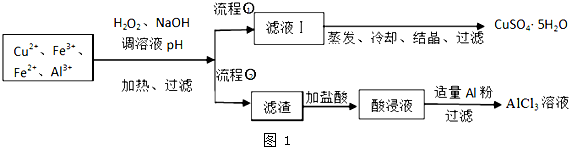
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
(1)加入H2O2的作用是将Fe2+氧化为Fe3+,欲使制取的CuSO4•5H2O晶体较为纯净,pH至少应调至5.0;
(2)写出H2O2与Fe2+离子方程式H2O2+2Fe2++2H+═2Fe3++2H2O;
(3)流程②中加入适量Al粉起的作用是与酸浸液中Fe3+和H+反应生成Al3+;
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3不能(填:能或不能),原因是直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝;
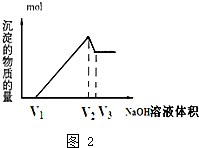
(5)取体积为V(L)的酸浸液,向其中滴加a mol•L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图2.请用V1、V2、V3表示所取的酸浸液中n(Fe3+):n(Al3+)$\frac{4{V}_{2}-{V}_{1}-3{V}_{3}}{3({V}_{3}-{V}_{2})}$.
已知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g.
【制备产品】将30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在100°C下反应30min,装置如图1所示.
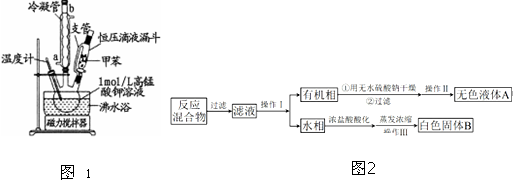
(1)图中冷凝管的进水口为a(填“a”或“b”).支管的作用是平衡压强,便于甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母).
A.50mL B.100mL C.200mL D.250mL
相对于用酒精灯直接加热,用沸水浴加热的优点是便于控制温度和使容器受热均匀.
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯(如图2).
(3)操作Ⅰ的名称是分液;含有杂质的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是蒸馏.
(4)测定白色固体的熔点,发现其在115°C开始熔化,达到130°C时仍有少量不熔.该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体加入水中,加热溶解,冷却结晶、过滤. | 得到白色晶体和无色溶液 | ╲ |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液. | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点. | 白色晶体在122.4℃左右时完全熔化 | 白色晶体是苯甲酸 |
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
| A. | 5.0 m o l/L | B. | 4.0 m o l/L | C. | 4.5 m o l/L | D. | 3.0 m o l/L |
| A. | 在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 | |
| B. | 熔融纯碱、烧碱时,不能选用石英坩埚,应该选用铁坩埚 | |
| C. | 蒸发结晶实验中,蒸发皿应放在石棉网上加热 | |
| D. | 在测量或监测温度时,温度计水银球碰到容器内壁不影响测量结果 |
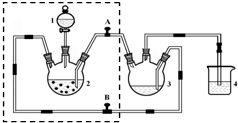 醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物([Cr(CH3COO)2)]2•2H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下: 无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):
无水四氯化锡(SnCl4)是一种用途广泛的锡化工中间体,纯品为无色液体,熔点-33℃,沸点114.1℃,易挥发,在湿空气中易水解而发烟.某同学设计用氯气与精锡反应制备无水四氯化锡,实验装置如图(部分夹持装置未画出):