题目内容
以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:

(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____ 。则“轻烧”温度应不超过 _____ 。
(2)流程图中“加热反应”的化学方程式为 _ _________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______ (已知Ksp[Mg(OH)2]=5.61×10-12)。
(4)该工艺中可以循环使用的物质是 、 (填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石 的方法,其优点是 、 。
(1)CaCO3、MgO(2分),700℃ (2分)
(2)(NH4)2SO4+MgO  MgSO4+2NH3↑+H2O (2分)
MgSO4+2NH3↑+H2O (2分)
(3)5.61×10-3mol·L-1(2分)
(4))(NH4)2SO4 (2分)、NH3或NH3·H2O
(5)减少能源消耗(2分)、便于CaCO3分离(2分)(其他合理答案也给分,如:减少CO2排放)
解析试题分析:(1)从过滤中可以得到CaCO3、来进行判断,可知分解的只是碳酸镁;从表中可以看出,温度低于540℃ 时,物质不分解,高于840℃ 时,碳酸钙和碳酸镁都分解,因此该温度不超过700℃。(2)加热的过程是放出氨气的过程,该过程中因为氧化镁跟水反应很少,因此涉及到的反应应该为:(NH4)2SO4+MgO  MgSO4+2NH3↑+H2O
MgSO4+2NH3↑+H2O
(3)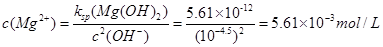
(4)(NH4)2SO4 (2分)、NH3或NH3·H2O
(5)减少能源消耗、便于CaCO3分离。
考点:考查物质的制备。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案下列关于合成氨工业的叙述可用勒夏特列原理来解释的是 ( )。
| A.使用铁触媒,使平衡向生成NH3的方向移动 |
| B.高压比常压条件更有利于合成氨的反应 |
| C.500 ℃左右比室温更有利于合成氨的反应 |
| D.合成氨时采用循环操作可提高原料的利用率 |

 2I-+S4O62-)
2I-+S4O62-)



 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓

 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
 2H2(g)+S2(g),其平衡常数表达式为K=。
2H2(g)+S2(g),其平衡常数表达式为K=。