题目内容
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
⑴ 2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O ⑵ NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
2NH3↑+CaCl2+2H2O ⑵ NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
⑶ 2CuS+3O2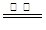 2CuO+2SO2 ⑷S2O52-+2H+=2SO2↑+H2O ⑸ CuSO4?5H2O
2CuO+2SO2 ⑷S2O52-+2H+=2SO2↑+H2O ⑸ CuSO4?5H2O
⑹ 2∶1 ①③⑥或①②③⑥
解析试题分析:(1)实验室制取氨气的药品是NH4Cl和Ca(OH)2固体,在加热条件下反应生成氨气。(2)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵。(3)有黑色固体可推知是CuO,说明流程中的CuS被空气氧化成CuO和SO2,根据化合价升降配平即可。(4)Na2S2O5与稀硫酸反应生成SO2,反应中S元素的化合价未发生变化,同时生成硫酸钠与水。(5)CuO与H2SO4生成CuSO4,将溶液CuSO4结晶可得到CuSO4·5H2O晶体。(6)反应Ⅱ中发生反应Na2CO3+H2O+2SO2=2NaHSO3+CO2↑,2NaHSO3 Na2S2O5+H2O故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应;碳酸钠的检验可将其转化为CO2气体检验,但SO2会干扰CO2的检验,所以应先除去SO2。
Na2S2O5+H2O故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应;碳酸钠的检验可将其转化为CO2气体检验,但SO2会干扰CO2的检验,所以应先除去SO2。
考点:考查无机化工生产工艺流程。

回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图:
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。
温度对GeCl4的水解率产生的影响如图1所示,其原因是 。 为控制最佳的反应温度,实验时可采取的措施为 (填序号)。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
已知以下四种物质的溶解度曲线图:
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为 。
| 物质 | 电离常数(25℃) |
| H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
| H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
工业上制取硫酸,回收尾气中的废气常选用的试剂是 ( )。
| A.氨水 | B.NaOH | C.H2SO3 | D.H2SO4 |
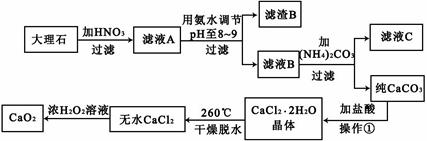



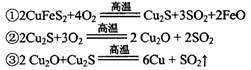
 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题:
