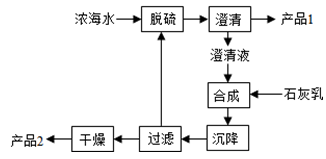
题目内容
(1)FeSO4·7H2O(名称、俗名亦可) 硫酸(H2SO4)
(2)防止Fe2+被氧化(合理答案均计分)
(3)TiO2+2Cl2+2C高温TiCl4+2CO(3分)(写CO2也给分)
(4)①酸污染 ②重金属离子(Cu2+、Cr3+等)污染(合理答案均计分)
中和法、沉淀法(合理答案均计分)
解析试题分析:(1)从流程图硫酸与过量的铁反应可知,副产品甲是FeSO4·7H2O,可循环利用的物质是硫酸。
(2)生产流程中加入铁屑的目的是防止Fe2+被氧化;
(4)“硫酸法”是酸性,会产生酸污染;与Ti共存的其它重金属的废液对水体有污染。
产生酸污染可以加入石灰中和,重金属离子污染可通过沉淀法除去。
考点:化学与技术。考查工业流程中使用和得到的产品物质,循环利用物质,废水的污染问题及处理措施。

丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下: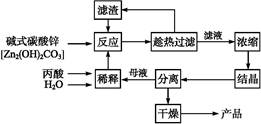
| 序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
| 1 | 1∶0.25 | 60 | 67.2 |
| 2 | 1∶0.25 | 80 | 83.5 |
| 3 | 1∶0.25 | 100 | 81.4 |
| 4 | 1∶0.31 | 60 | 89.2 |
| 5 | 1∶0.31 | 80 | 90.1 |
| 6 | 1∶0.31 | 100 | 88.8 |
(1)探究本实验中最佳工艺条件(见上表):反应时间2 h,用水量45 g,n(丙酸)∶n(碱式碳酸锌)=1∶
 ,反应温度 ℃。
,反应温度 ℃。 (2)本工艺采用“闭路循环”方式,除具有制备工艺简便、产率高外,还具有 的优点。
(3)某次实验时,将37.0 g丙酸溶于220 mL水中,按上述流程在上述优化的条件下制备,最终得丙酸锌49.6 g,则该次实验丙酸锌的产率为 (写出计算过程)。
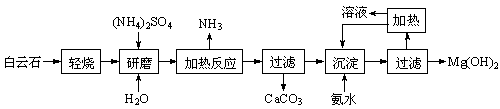
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
已知以下四种物质的溶解度曲线图:
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为 。
| 物质 | 电离常数(25℃) |
| H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
| H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO,下列叙述正确的是( )。
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3价 |
| D.氮化铝属于复合材料 |
 NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。