题目内容
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:①2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
②6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)在“反应液I”中加KOH固体的目的是 :
(4)加入硝酸铁溶液生成反应液Ⅱ的化学方程式:
(5)从“反应液Ⅱ”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
(6)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
温度较低 (2)2NaCl+2H2O Cl2↑+H2↑+2NaOH(3)与“反应液I”中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。(4)2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O(5)KNO3 KCl。KNO3是一种复合化肥。(6)研究温度对c(FeO42-)(或FeO42-水解反应)的影响 >。
Cl2↑+H2↑+2NaOH(3)与“反应液I”中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。(4)2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O(5)KNO3 KCl。KNO3是一种复合化肥。(6)研究温度对c(FeO42-)(或FeO42-水解反应)的影响 >。
解析试题分析:(1)在温度较低下发生反应① 2KOH + Cl2 =" KCl" + KClO + H2O,在温度较高时发生反应②6KOH+ 3Cl2 =" 5KCl" + KClO3 + 3H2O。现在要制备KClO。为了防止产生杂质KClO3。所以反应要在温度较低下进行。(2)在工业上Cl2是用电解饱和食盐水的方法制取的,反应的化学方程式是2NaCl+2H2O Cl2↑+H2↑+2NaOH。(3)在“反应液I”中要加KOH固体,目的是与反应液I中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。4)加入硝酸铁溶液发生反应的化学方程式:2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O。(5)由反应方程式可看出:分离出K2FeO4后,会得到副产品KNO3 KCl,它们都是重要的化工产品,其中KNO3 KNO3是一种复合化肥。用于农业生产,来达到增产、增收的目的。KCl可用于治疗糖尿病患者或高血压患者的的食用盐的添加剂等。(6)由图可看出:该实验的目的研究温度对c(FeO42-)(或FeO42-水解反应)的影响 。升高温度c(FeO42-)降低。说明升高温度,水解平衡向消耗该物质的方向移动。即升高温度,催进盐的水解。所以水解反应是吸热反应。故△H>0。
Cl2↑+H2↑+2NaOH。(3)在“反应液I”中要加KOH固体,目的是与反应液I中过量的Cl2继续反应,生成更多的KClO,为下一步反应提供反应物。4)加入硝酸铁溶液发生反应的化学方程式:2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O。(5)由反应方程式可看出:分离出K2FeO4后,会得到副产品KNO3 KCl,它们都是重要的化工产品,其中KNO3 KNO3是一种复合化肥。用于农业生产,来达到增产、增收的目的。KCl可用于治疗糖尿病患者或高血压患者的的食用盐的添加剂等。(6)由图可看出:该实验的目的研究温度对c(FeO42-)(或FeO42-水解反应)的影响 。升高温度c(FeO42-)降低。说明升高温度,水解平衡向消耗该物质的方向移动。即升高温度,催进盐的水解。所以水解反应是吸热反应。故△H>0。
考点:考查集氧化、吸附、絮凝于一体的新型多功能水处理剂高铁酸钾(K2FeO4)的生产工艺及制取过程中涉及的化学反应原理的知识。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图:
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。
温度对GeCl4的水解率产生的影响如图1所示,其原因是 。 为控制最佳的反应温度,实验时可采取的措施为 (填序号)。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
一包硫酸铵样品中,不慎混入了下列化肥:①氯化铵;②碳酸氢铵;③硝酸钾;④尿素[CO(NH2)2]中的一种。经测定,这种硫酸铵样品中含N的质量分数为23%,则混入的杂质可能是 ( )。
| A.①或② | B.①或④ |
| C.①或②或③ | D.②或③或④ |

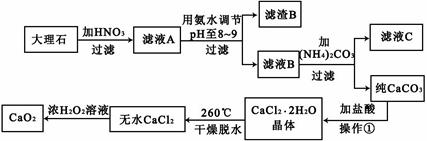






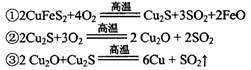
 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题: