题目内容
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: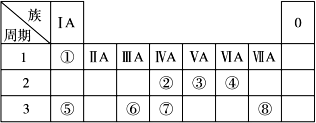
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
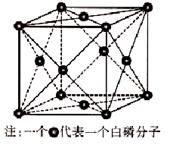
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
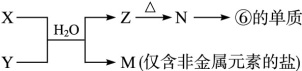
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
(1)第三周期,第ⅣA族 (2分)
(2)分子晶体 (2分)、 原子晶体 (2分)
(3) 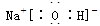 (2分)、
(2分)、 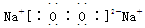 (2分) B (2分)
(2分) B (2分)
(4) BD (2分)
(5) b=a+1 b=a+11 b=a+25 (写对一个1分,二个2分,全对4分)。
(6)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (2分)
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子(其它合理答案给分)(2分)
解析试题分析:由题意可知①为H ②为C ③为N ④为O ⑤为Na ⑥为Al ⑦为Si ⑧为Cl,②的最高价氧化物为CO2,可形成分子晶体⑦的最高价氧化物为SiO2,可形成原子晶体。① 、④、 ⑤中的元素可形成的含离子键和共价键的离子化合物有NaOH、Na2O2. ①和④形成的化合物为H2O.由题意可知W为Se,与S同主族,但是非金属性比S弱,所以在常温下难与氢气化合且气态氢化物的稳定性比H2S弱,(5) 当X、Y同在二、三周期时b=a+1 、当X、Y同在四、五周期时b=a+11、当X、Y同在六、七周期时b="a+25" 。⑹突破口在于“Z→N→⑥的单质”。确定Z为Al(OH)3,M为仅含非金属元素的盐,所以为铵盐,确定X、Y为可溶性的铝盐和氨水。
考点:元素周期律、元素周期表的知识、晶体类型、电子式、元素化合物知识。

有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示) 。
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等。则原混合物中D单质的质量分数
为 。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。此时反应的化学方程式为 。
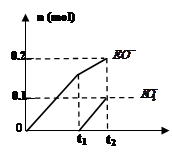
(5)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠的化合物。写出它与乙醇反应的化学方程式 。
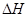 = ( 注:题中所涉单质均为最稳定单质)。
= ( 注:题中所涉单质均为最稳定单质)。
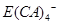 的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.
的形式存在,写出E溶于Z溶液的离子方程式:_________________________________________.