题目内容
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
(2)D、E、F的简单离子半径由大到小的顺序是(直接用化学式表示) 。
(3)向Fe和D单质组成的混合物中,加入足量F的最高价氧化物对应水化物的稀溶液,固体全部溶解。向所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等。则原混合物中D单质的质量分数
为 。
(4)一定量的石灰乳中通入一定量的E单质,两者恰好完全反应,生成物中有三种含E元素的离子,其中两种离子的物质的量(n)与反应时间(t)的曲线如图所示。此时反应的化学方程式为 。
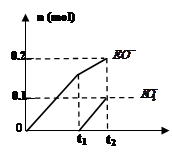
(5)A、B形成的化合物BA在有机合成中用途很广泛。它可以夺取很多化合物中的质子而生成相应的钠的化合物。写出它与乙醇反应的化学方程式 。
⑴H++HSO3-=SO2↑+H2O(2分) ⑵ S2->Cl->Al3+(2分) ⑶30%(2分)
⑷10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O (2分)
⑸NaH+CH3CH2OH→CH3CH2ONa+H2↑(2分)
解析试题分析:A的单质是密度最小的物质,故A是氢元素;B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子,且B是短周期元素,所以B是钠元素;C的原子最外层电子数是其内层电子数的三倍,且C是短周期元素,所以C是氧元素;D与B同周期,该周期中D的简单离子半径最小,故D是铝元素;B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分,消毒剂的主要成分是次氯酸钠,所以E是氯元素;F元素最高正价与最低负价的代数和为4,且F是短周期元素,所以F是硫元素。
(1)两种均含A、B、C、F四种元素的化合物在溶液中相互反应,则两种化合物应该是硫酸氢钠和亚硫酸氢钠,二者反应的离子方程式为H++HSO3-=SO2↑+H2O。
(2)离子核外电子层数越多,离子半径越大。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以D、E、F的简单离子半径由大到小的顺序是S2->Cl->Al3+。
(3)铁与铝与稀硫酸反应生成硫酸铝和硫酸亚铁,加入双氧水后硫酸亚铁被氧化生成硫酸铁,然后再加入过量氢氧化钠溶液生成氢氧化铁和偏铝酸钠,过滤洗涤干燥后氢氧化铁分解生成氧化铁。该固体的质量和原混合物的质量恰好相等,这说明氧化铁中氧元素的质量等于原混合物中D单质的质量,所以原混合物中D单质的质量分数=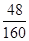 ×100%=30%。
×100%=30%。
(4)根据图像可知生成物次氯酸钙与氯酸钙的物质的量之比=2:1,由于二者是还原产物,其中氯元素的化合价从0价分别降低到+1价和+5价,所以根据电子的得失守恒可知,氧化产物氯化钙的物质的量与氯酸钙、次氯酸钙的物质的量之比=7:1:2,因此该反应的离子方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O。
(5)乙醇中羟基氢原子的活泼性较强,因此NaH与乙醇反应的化学方程式为NaH+CH3CH2OH→CH3CH2ONa+H2↑。
考点:考查元素周期表的结构、元素周期律的应用以及氧化还原反应的有关判断和计算

 口算能手系列答案
口算能手系列答案根据表中信息回答下列问题。
| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
(1)S在元素周期表中的位置是 。
(2)根据表中信息可知,Si、P、S、Cl 四种元素的的非金属性依次增强。用原子结构解释原因:同周期元素电子层数相同,从左至右, ,原子半径逐渐减小,得电子能力逐渐增强。
(3)25℃时,以上四种元素的单质与氢气反应生成l mol气态氢化物的反应热如下:
a.+34.3 kJ·mol-1 b.+9.3 kJ·mol-1 c.?20.6 kJ·mol-1 d.?92.3 kJ·mol-1
请写出固态白磷(P4)与H2反应生成气态氢化物的热化学方程式 。
(4)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。已知硒(Se)是人体必需的微量元素,其部分信息如图。
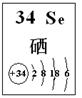
①下列有关说法正确的是 (填字母)。
a. 原子半径:Se>S>P b. 稳定性:H2Se>H2S
c. 因为酸性H2Se<HCl,所以非金属性Se<Cl
d. SeO2是酸性氧化物,能与烧碱溶液反应
②在下表中列出对H2SeO3各种不同化学性质的推测,举例并写出相应的化学方程式。
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI=Se↓+2I2+3H2O |
| 2 | | |
| 3 | | |
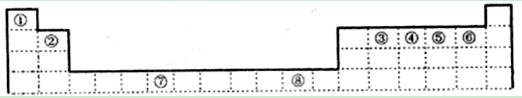
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: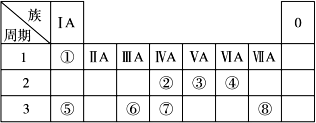
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是( )
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
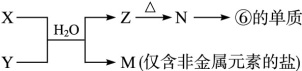
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
常见元素X、Y、Z、W的原子序数依次增大,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y | Y的基态原子最外层电子数是其内层电子总数的2.5倍 |
| Z | Z的基态价电子结构为nsn-1 |
| W | W单质常在火山口附近被发现,其氧化物是造成酸雨的主要原因之一 |
(1)Y位于元素周期表第 周期 族,其基态原子未成对电子有 个。
(2)X的电负性比W的 (填“大”或“小”);Y的最简单气态氢化物比X的最简单气态氢化物易液化,其主要原因是 。
(3)Z与同周期左右相邻的两种元素的原子相比较,三者第一电离能由大到小的顺序为 (用元素符号表示)。Y和Z形成的化合物为 晶体,该物质遇水强烈水解的化学方程式为 。
(4)在一定温度下,向一个容积不变的密闭容器中充入1molY2和3mol氢气,发生反应:Y2(g)+3H2(g) 2YH3(g) ΔH=-akJ/mol。在该条件下达到平衡时放出的热量为bkJ,其平衡常数表达式K= 。若起始向此容器中充入2molYH3,在相同温度下达到平衡时,反应过程中吸收的热量为ckJ,则a、b、c三者之间的关系为 (用一个式子表示)。