题目内容
【题目】空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g) =2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH= _______ kJ·mol-1
2NH3(g) ΔH= _______ kJ·mol-1
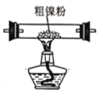
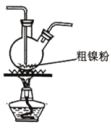
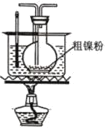
(2)以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨方面取得了突破性进展。其工作原理如图所示:
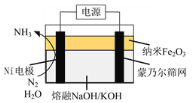
①Ni电极处发生的总反应为: N2+6e-+6H2O=2NH3+6OH-
已知该反应分为两步,其中第二步的反应为2Fe+3H2O+N2=2NH3+Fe2O3,则第一步反应为 _______ 。
②蒙乃尔筛网处发生的电极反应为: _______ 。
(3)NH3可以合成尿素,反应为2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
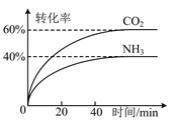
①下列情况能说明反应达到平衡状态的是 _______ 。
A NH3和CO2的物质的量之比为2∶1
B 容器内气体的密度保持不变
C 2v正(NH3)=v逆(CO2)
D 各气体的体积分数保持不变
②起始时NH3和CO2的物质的量之比为 _______ 。
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,则达到新平衡时NH3的体积分数为 _______ 。
【答案】(b+![]() -
-![]() ) Fe2O3+6e-+3H2O=2Fe+6OH- 4OH--4e-=2H2O+O2↑ BD 3∶1 52.94%
) Fe2O3+6e-+3H2O=2Fe+6OH- 4OH--4e-=2H2O+O2↑ BD 3∶1 52.94%
【解析】
(1)可根据盖斯定理由已知反应求得目标反应的焓变;
(2)观察其工作原理图可知,Ni电极变化为N2→NH3,发生还原反应,是阴极,则蒙乃尔筛网处是阳极,发生氧化反应。
(3)①反应达到平衡状态时,正逆反应速率相等,各组分的浓度保持不变及由此衍生的其他物理量进行分析;
②设起始时NH3和CO2的物质的量分别为n(NH3)、n(CO2),反应消耗的CO2的物质的量为x,结合方程式列三段式,结合氨气、二氧化碳的转化率进行分析计算,求出n(NH3):n(CO2);
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,进行转化,通过把生成物全部转化为反应物后,可知转化后比值相等,与原平衡等效,则达到新平衡时NH3的体积分数与原平衡相同,所以,只需计算原平衡中NH3的体积分数即可。
(1)由已知:①2H2(g)+O2(g)=2H2O(l) ΔH=a k·mol-1
②N2(g)+O2(g) =2NO(g) ΔH=b k·mol-1
③4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH=c k·mol-1
根据盖斯定理,可由①×![]() +②-③×
+②-③×![]() 得反应:N2(g)+3H2(g)
得反应:N2(g)+3H2(g) ![]() 2NH3(g),则ΔH= (b+
2NH3(g),则ΔH= (b+![]() -
-![]() )k·mol-1。答案为:(b+
)k·mol-1。答案为:(b+![]() -
-![]() )
)
(2)①用总反应减第二步的反应得:Fe2O3+6e-+3H2O=2Fe+6OH-。答案为:Fe2O3+6e-+3H2O=2Fe+6OH-
②蒙乃尔筛网处是阳极,OH-放电,发生氧化反应:4OH--4e-=2H2O+O2↑。答案为:4OH--4e-=2H2O+O2↑
(3)①A. NH3和CO2的物质的量之比为2∶1时不一定达到平衡,A选项错误;
B. 反应体系条件为恒温恒压,平衡移动,气体物质的量变化,所以气体体积也变化,而体系气体质量不变,所以密度会随平衡的移动而变化,密度不变时反应达到平衡状态,B选项正确;
C. 由2v正(NH3)=v逆(CO2),得v正(NH3):v逆(CO2)=1:2,不等于计量数之比,反应没有达到平衡状态,C选项错误;
D. 根据化学平衡状态的定义,平衡时各组分的百分含量保持不变,D选项正确;
答案为:BD
②设起始时NH3和CO2的物质的量分别为n(NH3)、n(CO2),反应消耗的CO2的物质的量为x,则有:
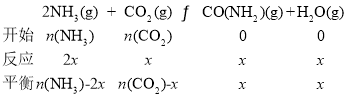
![]() ,
,![]()
解得:![]()
答案为:3∶1
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,进行转化:
转化后比值相等,与原平衡等效,则达到新平衡时NH3的体积分数与原平衡相同,所以,只需计算原平衡中NH3的体积分数即可。
在②的计算中,n(NH3)=3n(CO2),x=0.6 n(CO2),则平衡时总物质的量为n(NH3)- 2x+ n(CO2)-x+ x + x = n(NH3)+ n(CO2)-x=3.4 n(CO2),则达到新平衡时NH3的体积分数为:
![]()
答案为:52.94%

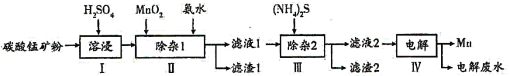
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:
已知25℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是__________(至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________、___________。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________。
(4)滤液2中,c(Co2+):c(Ni2+)=____________。