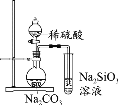
题目内容
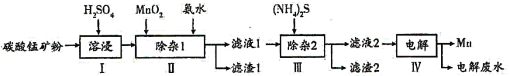
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:
已知25℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是__________(至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________、___________。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________。
(4)滤液2中,c(Co2+):c(Ni2+)=____________。
【答案】溶浸时加热(或升高温度)、适当增大硫酸浓度、搅拌、减小矿粉颗粒直径等 SiO2、Fe(OH)3 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 若(NH4)2S的浓度过大,产生MnS沉淀造成产品损失 5:1
【解析】
向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰。
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有加热或搅拌或增大硫酸浓度等;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入氨水调节pH为5.0~6.0,发生Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+,可得到沉淀Fe(OH)3,另外原矿物中含有的SiO2不溶于酸和氨水,则过滤时所得滤渣1的主要成分为SiO2、Fe(OH)3;
(3)向滤液中滴入适量的(NH4)2S溶液,目的是除去Cu2+、Zn2+,若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失;
(4)CoS、NiS的Ksp分别为5.0×10-22、1.0×10-22,加入足量(NH4)2S溶液后,生成CoS、NiS沉淀,溶液中c(Co2+):c(Ni2+)=5.0×10-22:1.0×10-22=5:1。

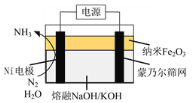
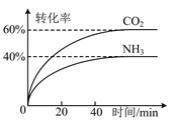
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
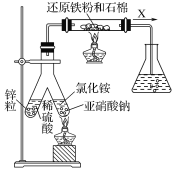
(1)实验室可用上图所示装置合成氨。
①亚硝酸钠与氯化铵反应的离子方程式为NO2-+NH4+![]() N2↑+2H2O。
N2↑+2H2O。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、________和________(填化学式)。
(2)最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨汽化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热ΔH=________。