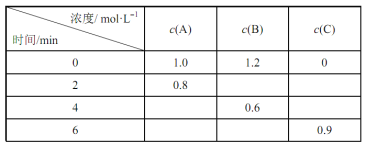
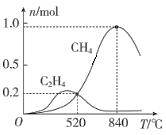
题目内容
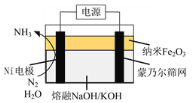
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。

已知:CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl;Ni(CO)4 熔点-25℃,沸点 43℃,60℃以上与空气混合易爆炸;Fe(CO)5 熔点-20℃,沸点 103℃。回答下列问题:
(1)装置 A 中发生反应的化学方程式为_____。
(2)装置 C 用于合成 Ni(CO)4(夹持装置略),最适宜选用的装置为________(填标号)。
①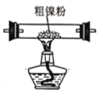 ②
②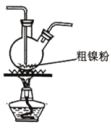 ③
③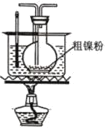
(3)实验过程中为了防止_________,必须先观察________(填实验现象)再加热 C 装置。
(4)利用“封管实验”原理可获得(高纯镍。如图所示的石英)玻璃封管中充有 CO 气体,则高纯镍粉在封管的________温度区域端生成 填“323K”或“473K” 。

(5)实验中加入 11.50 g HCOOH,C 装置质量减轻 2.95 g(设杂质不参加反应),E 装置中盛有 PdCl2 溶液100 mL,则 PdCl2 溶液的物质的量浓度至少为________mol·L-1。
【答案】HCOOH H2O+CO↑ ③ CO 及 Ni(CO)4 与装置中空气混合在加热条件下爆炸 E 装置中产生黑色沉淀 473K 0.50
H2O+CO↑ ③ CO 及 Ni(CO)4 与装置中空气混合在加热条件下爆炸 E 装置中产生黑色沉淀 473K 0.50
【解析】
A装置中甲酸和浓硫酸反应生成CO,经B装置中浓硫酸进行干燥,根据方程式Ni(CO)4(g)![]() Ni(s)+4CO(g),温度在50~80℃是更有利于Ni(CO)4的生成,为了更好的控制温度可选用水浴加热,Ni(CO)4的沸点为43℃,所以反应生成的Ni(CO)4会变成气体,在D装置中进行冷凝得到Ni(CO)4液体,之后利用E装置吸收未反应的CO,同时为了防止Ni(CO)4与空气混合加热,需先通一段时间的CO,通过观察E装置中是否有黑色成生成可判断装置中是否充满CO。
Ni(s)+4CO(g),温度在50~80℃是更有利于Ni(CO)4的生成,为了更好的控制温度可选用水浴加热,Ni(CO)4的沸点为43℃,所以反应生成的Ni(CO)4会变成气体,在D装置中进行冷凝得到Ni(CO)4液体,之后利用E装置吸收未反应的CO,同时为了防止Ni(CO)4与空气混合加热,需先通一段时间的CO,通过观察E装置中是否有黑色成生成可判断装置中是否充满CO。
(1)装置A中甲酸与在浓硫酸的作用下生成CO和水,反应方程式为HCOOH H2O+CO↑;
H2O+CO↑;
(2)温度在50~80℃是更有利于Ni(CO)4的生成,为了更好的控制温度,且可避免温度过高,可选用水浴加热,所以选用③装置;
(3)CO 及 Ni(CO)4 与装置中空气混合在加热条件下会发生爆炸,所以要先观察到E装置中生成黑色沉淀,再加热C装置;
(4)323K是49.85℃,473K是199.85℃,根据方程式Ni(CO)4 (g)![]() Ni(s)+4CO(g)可知180~200℃时生成Ni单质,所以高纯镍粉在封管的473K温度区域端生成;
Ni(s)+4CO(g)可知180~200℃时生成Ni单质,所以高纯镍粉在封管的473K温度区域端生成;
(5)n(HCOOH)=![]() =0.25mol,则生成的n(CO)=0.25mol,C装置中发生Ni(s)+4CO(g)
=0.25mol,则生成的n(CO)=0.25mol,C装置中发生Ni(s)+4CO(g)![]() Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=
Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=![]() =0.05mol,则消耗n(CO)=0.2mol,所以PdCl2 溶液至少要吸收CO的物质的量为0.25mol-0.2mol=0.05mol,根据方程式CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl可知所需n(PdCl2)=0.05mol,所以其浓度至少为
=0.05mol,则消耗n(CO)=0.2mol,所以PdCl2 溶液至少要吸收CO的物质的量为0.25mol-0.2mol=0.05mol,根据方程式CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl可知所需n(PdCl2)=0.05mol,所以其浓度至少为![]() =0.5mol/L。
=0.5mol/L。

【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向某溶液中先滴加稀硝酸,再滴加 | 该溶液中一定含有 |
B | 向 |
|
C | 向 |
|
D | 用 | 酸性: |
A.AB.BC.CD.D