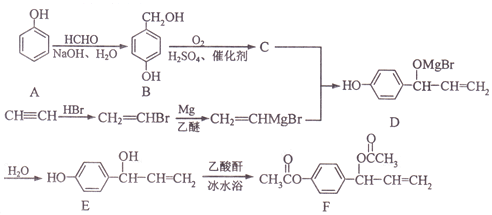
题目内容
【题目】下列方程式书写正确的是( )
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3Ca2++CO32-
【答案】A
【解析】
A. HCO3-为多元弱酸的酸式酸根离子,部分电离,用可逆号表示,则其在水溶液中的电离方程式为:HCO3- ![]() H++CO32-,也可表示为HCO3-+H2O
H++CO32-,也可表示为HCO3-+H2O![]() H3O++CO32-,A项正确;
H3O++CO32-,A项正确;
B. H2SO3为二元弱酸,部分电离,且分步电离,主要为第一步电离,其电离方程式为:H2SO3H++HSO3-,B项错误;
C. CO32-为多元弱酸的酸根离子,分步水解,主要为第一步水解,其水解方程式:CO32-+H2O![]() HCO3-+OH-,C项错误;
HCO3-+OH-,C项错误;
D. CaCO3属于强电解质,能完全电离,其电离方程式:CaCO3=Ca2++CO32-,D项错误;
答案选A。

【题目】在生产生活和科学研究中,人们常常根据需要促进或抑制盐的水解。试回答下列问题:
(1)FeCl2溶液呈____(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):____;实验室在配制FeCl2溶液时,常将FeCl2固体先溶于较浓的盐酸中,以_____(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)用离子方程式表示硫酸铝溶液和碳酸氢钠溶液混合时发生的主要反应____。
(3)为证明盐的水解是吸热的,四位同学分别设计了如下方案,其中正确的是____。
A.甲同学:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热的。 |
B.乙同学:将硝酸铵晶体溶于水,水温降低,说明盐类水解是吸热的。 |
C.丙同学:在氨水加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热的。 |
D.丁同学:在醋酸钠溶液中滴加2滴酚酞试剂,加热后红色加深,说明盐类水解是吸热的。 |
(4)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是___。
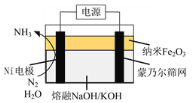
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
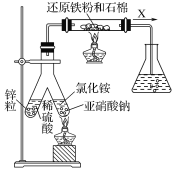
(1)实验室可用上图所示装置合成氨。
①亚硝酸钠与氯化铵反应的离子方程式为NO2-+NH4+![]() N2↑+2H2O。
N2↑+2H2O。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、________和________(填化学式)。
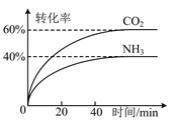
(2)最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨汽化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热ΔH=________。