题目内容
10.下列鉴别方法可行的是( )| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用二氧化碳鉴别CaCl2溶液和NaCl溶液 | |
| C. | 用铁片鉴别稀H2SO4和浓H2SO4 | |
| D. | 用相互滴加的方法鉴别NaHCO3溶液和Ca(OH)2溶液 |
分析 A、氨水和氯化镁,氯化铝反应都生成白色沉淀;
B、二氧化碳和氯化钙、氯化钠都不发生反应;
C、铁和稀硫酸发生反应,常温下在浓硫酸中发生钝化反应阻止反应进行;
D、Ca(OH)2和NaHCO3溶液生成CaCO3沉淀;
解答 解:A、氨水和氯化镁,氯化铝反应都生成白色沉淀,氢氧化镁、氢氧化铝都不溶于过量氨水,用氨水不能鉴别MgCl2溶液和AlCl3溶液,故A错误;
B、二氧化碳和氯化钙、氯化钠都不发生反应,用二氧化碳不能鉴别CaCl2溶液和NaCl溶液,故B错误;
C、铁和稀硫酸发生反应生成氢气,铁可以全部溶解,常温下铁在浓硫酸中发生钝化,阻止反应进行,不能全部溶解,可以鉴别,故C正确;
D、Ca(OH)2和NaHCO3溶液生成CaCO3沉淀,不能用相互滴加的方法鉴别,故D错误;
故选:C.
点评 本题考查了物质检验方法的分析应用,主要是物质性质的理解应用,反应现象和过量反应的产物分析与现象判断是解题关键,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
12.设 NA为阿伏加德罗常数,下列说法中错误的是( )
| A. | 在标准状况下,22.4LSO3所含的硫原子数目为NA | |
| B. | 常温常压下,7.8g过氧化钠含有的离子数为0.3NA | |
| C. | 18 g 水所含的电子数目为10 NA | |
| D. | 3.2g O2、O3混合物中所含氧原子一定是0.2NA |
1.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H=-Q kJ/mol(Q>0) |
5.有关晶体的下列说法中正确的是( )
| A. | 原子晶体中共价键越强,熔点越高 | |
| B. | 晶体中分子间作用力越大,分子越稳定 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氯化钠熔化时离子键未被破坏 |
15.下表是A、B两种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应;在浓硫酸作用下,B与浓硝酸反应的化学方程式是 .
.
| A | B |
| ①由C、H两种元素组成; ②能使溴的四氯化碳溶液褪色; ③比例模型为:  | ①由C、H两种元素组成; ②球棍模型为: 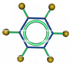 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应;在浓硫酸作用下,B与浓硝酸反应的化学方程式是
 .
.
2.主族元素R的最高正化合价为+5,R元素位于周期表的( )
| A. | ⅠA族 | B. | ⅡA族 | C. | ⅢA族 | D. | ⅤA族 |
19.短周期元素X和Y,X原子的电子层数为n,最外层电子数为(2n+1),Y原子最外层电子数是次外层电子数的3倍.下列说法一定正确的是( )
| A. | X和Y都是非金属元素,其中X的最高化合价为+5价 | |
| B. | X与Y所能形成的化合物都是酸性氧化物 | |
| C. | 元素X的氧化物的水化物是强酸 | |
| D. | X的氢化物极易溶于水,可以用来做喷泉实验 |
20.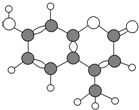 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
 某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )
某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述不正确的是( )| A. | 1mol该物质完全燃烧最多能消耗10.5mol的氧气 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 1mol该物质最多能与4 molH2加成 | |
| D. | 分子式为C10H9O3 |