题目内容
15.下表是A、B两种有机物的有关信息:| A | B |
| ①由C、H两种元素组成; ②能使溴的四氯化碳溶液褪色; ③比例模型为:  | ①由C、H两种元素组成; ②球棍模型为:  |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成分子C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体②有毒③不溶于水④密度比水大⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应;在浓硫酸作用下,B与浓硝酸反应的化学方程式是
 .
.
分析 (1)依据性质和模型分析判断,A是乙烯,B是苯,依据乙烯存在不饱和双键能发生加成反应,系统命名方法得到名称;
(2)依据烯烃与氢气加成生成烷烃,分子当n=4时,这类有机物开始出现同分异构体;
(3)B是苯,是无色具有特殊气味的有毒液体,密度小于水,分子结构是六个碳碳键完全等同的化学键,易取代,难氧化,难加成;苯与浓硝酸发生取代反应生成硝基苯.
解答 解:(1)由信息知,A是乙烯,B是苯;乙烯存在碳(碳双键,能发生加成反应,CH2=CH2+Br2→CH2BrCH2Br (1,2-二溴乙烷);
故答案为:1,2-二溴乙烷;
(2)乙烯与氢气发生加成反应后生成分子乙烷,与乙烷在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体,
故答案为:4;
(3)苯在常温下是一种无色、味甜、有芳香气味的透明液体,易挥发,比水密度小,难溶于水.苯参加的化学反应大致有3:一是其他基团和苯环上的氢原子之间发生的取代反应;二是发生在苯环上的加成反应;三是苯环的断裂.不能和高锰酸钾溶液、溴水发生反应,可以和氢气发生加成反应;
在浓硫酸作用下,苯与浓硝酸发生取代反应生成硝基苯,反应方程式为: ,
,
故答案为:②③; .
.
点评 本题主要考查乙烯和苯的结构与性质,熟练掌握物质性质是解题关键,题目较简单.

练习册系列答案
相关题目
17.下列有说法不正确的是( )
| A. | 离子晶体的晶格能是气态离子形成1mol晶胞时放出的能量 | |
| B. | 金属的六方最密堆积和面心立方最密堆积的空间利用率最高 | |
| C. | 钠晶胞结构如图 ,钠晶胞中每个钠原子的配位数为8 ,钠晶胞中每个钠原子的配位数为8 | |
| D. | 温度升高,金属的导电性将变弱 |
6.将水蒸气通过红热的碳可产生水煤气,以此产物为原料可生产多种产品.
(1)已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是AD.
A.升高温度B.增加碳的用量C.加入催化剂D.用储氢金属吸收H2
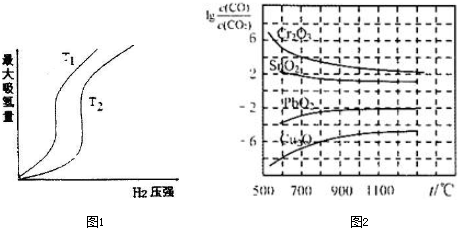
(2)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2(g)?MH2(s)△H<0(M表示某种合金).如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系,则T1<T2(填“<”、“>”或“=”).
(3)某温度下,在2L体积不变的密闭容器中将1molCO和2molH2混合发生反应:CO(g)+2H2(g)?CH3OH(g),测得不同时刻的反应前后压强关系如表:
反应在前10min的平均速率v(H2)=0.015mol•L-1•min-1.达到平衡时CO的转化率为51%.
(4)CO可以还原某些金属氧化物生成金属单质和CO2,如图2是四种金属氧化物被CO还原时1g[$\frac{c(CO)}{c(C{O}_{2})}$)]与温度(T)的关系曲线图.
①其中最易被还原的金属氧化物是Cu2O(填化学式).
②700℃时CO还原Cr2O3反应中的平衡常数k=10-12.
(5)水煤气处理后,获得的较纯H2用于合成氨:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.如图3为不同实验条件下进行合成氨反应实验,N2浓度随时间变化示意图.
①与实验Ⅰ比较,实验Ⅱ改变的条件为使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图4中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图 .
.
(6)饮用水中的NO3-主要来自于NH4+,已知在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图5.请写出1molNH4+(aq)的热化学方程式NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.

(1)已知:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ/mol,达到平衡后,体积不变时,能提高H2O的平衡转化率的措施是AD.
A.升高温度B.增加碳的用量C.加入催化剂D.用储氢金属吸收H2

(2)某些合金可用于储存氢,金属储氢的原理可表示为:M(s)+xH2(g)?MH2(s)△H<0(M表示某种合金).如图1表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系,则T1<T2(填“<”、“>”或“=”).
(3)某温度下,在2L体积不变的密闭容器中将1molCO和2molH2混合发生反应:CO(g)+2H2(g)?CH3OH(g),测得不同时刻的反应前后压强关系如表:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比($\frac{{P}_{后}}{{P}_{前}}$) | 0.98 | 0.90 | 0.78 | 0.66 | 0.66 | 0.66 |
(4)CO可以还原某些金属氧化物生成金属单质和CO2,如图2是四种金属氧化物被CO还原时1g[$\frac{c(CO)}{c(C{O}_{2})}$)]与温度(T)的关系曲线图.
①其中最易被还原的金属氧化物是Cu2O(填化学式).
②700℃时CO还原Cr2O3反应中的平衡常数k=10-12.
(5)水煤气处理后,获得的较纯H2用于合成氨:N2(g)+3H2(g)?2NH3(g),△H=-92.4kJ•mol-1.如图3为不同实验条件下进行合成氨反应实验,N2浓度随时间变化示意图.
①与实验Ⅰ比较,实验Ⅱ改变的条件为使用催化剂.
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,请在图4中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
 .
.(6)饮用水中的NO3-主要来自于NH4+,已知在微生物作用下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图5.请写出1molNH4+(aq)的热化学方程式NH4+(aq)+2O2(g)═2H+(aq)+H2O(l)+NO3-(aq),△H=-346 kJ/mol.

3.下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是( )
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | HCl | ClO-+H+=HClO |
| C | Ba2+、Al3+、Cl-、H+ | 少量NaOH | Al3++3OH-=Al(OH)3↓ |
| D | S2O32-、Na+、Cl-、SO32-、K+ | 过量硫酸 | 2S2O32-+2H+=SO42-+3S↓+H2O |
| A. | A | B. | B | C. | C | D. | D |
10.下列鉴别方法可行的是( )
| A. | 用氨水鉴别MgCl2溶液和AlCl3溶液 | |
| B. | 用二氧化碳鉴别CaCl2溶液和NaCl溶液 | |
| C. | 用铁片鉴别稀H2SO4和浓H2SO4 | |
| D. | 用相互滴加的方法鉴别NaHCO3溶液和Ca(OH)2溶液 |
20.短周期元素A、B、C、D、E是同周期的五种元素,A和B的最高价氧化物对应水化物呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D,五种元素形成的简单离子中E的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A. | C、D、E、A、B | B. | E、C、D、A、B | C. | B、A、D、C、E | D. | B、A、E、D、C |
7.下列说法中,正确的是( )
| A. | s区元素都是金属元素 | B. | p区元素全部都是非金属元素 | ||
| C. | d区、ds区和f区由副族元素组成 | D. | s区和p区由主族和0族元素组成 |
4.以下说法正确的是( )
| A. | 金属元素与非金属元素的原子间只形成离子键 | |
| B. | 原子或离子间相互的吸引力叫化学键 | |
| C. | 非金属元素间只能形成共价键 | |
| D. | 共价化合物内部可能有极性键和非极性键 |
5.有机物的命名是有规则的,下列有机物用系统命名法命名正确的是( )
| A. | 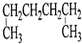 1,4-二甲基丁烷 | B. | 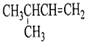 3-甲基丁烯 | C. | 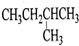 2-甲基丁烷 | D. | 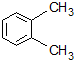 邻二甲苯 |