题目内容
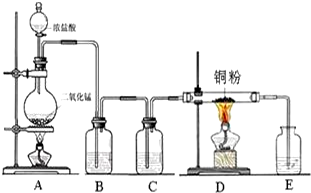
3.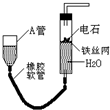 如图的实验装置可用于实验室中制取乙炔及成份检验.
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
(1)图中,A管的作用是调节水面高度以控制反应的发生和停止,制取乙炔的化学方程式为CaC2+2H2O=Ca(OH)2+C2H2↑.
(2)将制得的乙炔通入酸性KMnO4溶液中可观察到的现象是KMnO4溶液褪色,这是由于乙炔发生了氧化反应.
(3)将制得的乙炔通入溴的四氯化碳溶液中可观察到的现象是溴的四氯化碳溶液褪色,这是由于乙炔发生了加成反应.
(4)为了安全,乙炔气体在点燃前应检查乙炔的纯度,乙炔燃烧时的现象是火焰明亮并伴有浓烈的黑烟.
(5)验证电石与水反应生成的乙炔和溴发生加成反应,下列叙述正确的是AC(多选扣分).
a.使溴水褪色的反应,未必是加成反应 b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔 d.使溴水褪色的物质,就是乙炔.
分析 (1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔;
(2)乙炔能使酸性高锰酸钾溶液褪色,发生氧化反应;
(3)乙炔能使溴的四氯化碳溶液褪色发生加成反应;
(4)可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟;
(5)能与溴发生反应的有苯酚、不饱和烃等,生成的乙炔含有硫化氢,可与溴发生氧化还原反应.
解答 解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O=Ca(OH)2+C2H2↑,
故答案为:调节水面高度以控制反应的发生和停止;CaC2+2H2O=Ca(OH)2+C2H2↑;
(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:KMnO4溶液褪色;氧化;
(3)乙炔能够和溴水发生加成反应,可使溶液褪色,方程式为C2H2+2Br2=CHBr2CHBr2,故答案为:溴的四氯化碳溶液褪色;加成;
(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸.因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟,
故答案为:检查乙炔的纯度;火焰明亮并伴有浓烈的黑烟;
(5)生成的乙炔中往往混有硫化氢等气体,可与溴发生氧化还原反应而使溶液褪色,则A、C正确,BD错误,故答案为:AC.
点评 本题考查乙炔的实验室制法及其性质,侧重基础知识的考查,有利于培养学生的分析能力和实验能力,注意相关基础知识的积累,题目难度不大.

练习册系列答案
相关题目
11.几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,下列叙述正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 单质与氢气化合的难易程度:Z>L | |
| B. | Y的氧化物对应的水化物不能溶于过量的氨水 | |
| C. | Z单质在氧气中燃烧生成ZO3 | |
| D. | L、Q形成的简单离子核外电子数相等 |
18.等物质的量的甲烷与氯气在光照条件下反应产物可能有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
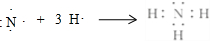
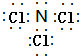
 .
. 实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题:
实验室里用如图所示装置制取纯净的无水CuCl2.试回答下列问题: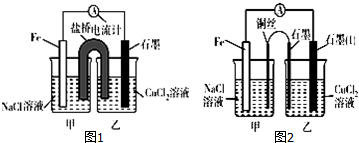
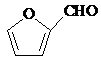 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$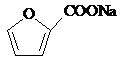 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.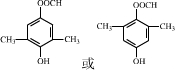 .
.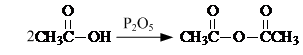 .
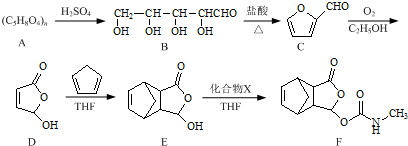
.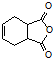 是合成抗病毒药阿昔洛韦的中间体,它可以用
是合成抗病毒药阿昔洛韦的中间体,它可以用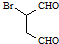 经氧化、消去、成酐一系列反应后再和原料M合成.
经氧化、消去、成酐一系列反应后再和原料M合成.