题目内容
11.几种短周期元素的原子半径和主要化合价见下表,下列有关说法中,下列叙述正确的是( )| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
| A. | 单质与氢气化合的难易程度:Z>L | |
| B. | Y的氧化物对应的水化物不能溶于过量的氨水 | |
| C. | Z单质在氧气中燃烧生成ZO3 | |
| D. | L、Q形成的简单离子核外电子数相等 |
分析 主族元素中,元素最高正化合价与其族序数相等,最低负化合价=族序数-8,原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中化合价知,X位于第IIA族、Y位于第IIIA族、Z和Q位于第VIA族、L位于第VIIA族、M位于第IVA族;
X原子半径最大,应该是Mg元素;
Y原子半径和X相近且需要X,所以为Al元素;
Z原子半径大于Q,所以Z是S元素、Q是O元素;
L有正化合价为Cl元素,M原子半径大于O元素且小于S元素,所以为C元素,
再结合物质结构、性质解答.
解答 解:主族元素中,元素最高正化合价与其族序数相等,最低负化合价=族序数-8,原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中化合价知,X位于第IIA族、Y位于第IIIA族、Z和Q位于第VIA族、L位于第VIIA族、M位于第IVA族;
X原子半径最大,应该是Mg元素;
Y原子半径和X相近且需要X,所以为Al元素;
Z原子半径大于Q,所以Z是S元素、Q是O元素;
L有正化合价为Cl元素,M原子半径大于O元素且小于S元素,所以为C元素,
A.元素的非金属性越强,其单质与氢气化合越容易,非金属性L>Z,所以单质与氢气化合的难易程度:L>Z,故A错误;
B.Y的氧化物的氧化铝,属于两性氧化物,能溶于强碱但不溶于弱碱,一水合氨是弱碱,所以氧化铝不溶于氨水,故B正确;
C.Z是S,S在氧气中燃烧生成二氧化硫,故C错误;
D.L形成离子核外电子数是18、Q形成离子核外电子数是10,所以不相等,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,正确判断元素是解本题关键,易错选项是C,注意:S在空气或氧气中燃烧都生成二氧化硫而不是三氧化硫,与氧气的量多少无关.

 阅读快车系列答案
阅读快车系列答案| A. | X、Y、Z的原子序数依次增大 | |
| B. | X与Z形成的化合物为离子化合物 | |
| C. | X与Y形成的化合物只含共价键 | |
| D. | 存放Z单质的仓库失火不能用CO2灭火 |
| A. | 焚烧树叶,以减少垃圾运输量 | |
| B. | 将废弃塑料就地烧掉,以消除“白色污染” | |
| C. | 加高工厂烟囱,以减少二氧化硫对环境的污染 | |
| D. | 运输沙土的车辆盖上苫布,以免增加空气中的粉尘含量 |
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在Fe3+、K+、Cl?、SO42? | |
| C. | 弱碱性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? |
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
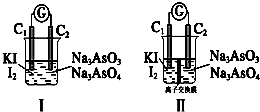
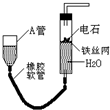 如图的实验装置可用于实验室中制取乙炔及成份检验.
如图的实验装置可用于实验室中制取乙炔及成份检验. ;
;