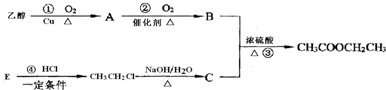
题目内容
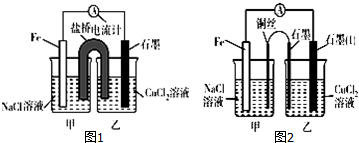
8.某实验小组的同学对电化学原理进行了一系列探究活动.(1)如图1为某实验小组依据氧化还原反应:Fe+Cu2+═Fe2++Cu(用离子方程式表示)设计的原电池装置,反应前,两电极质量相等,一段时间后,两电极质量相差18g,则导线中通过0.3mol电子.
(2)用胶头滴管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式2Fe2++Cl2═2Fe3++2Cl-,然后滴加几滴硫氰化钾溶液,溶液变红;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”.如果+3价铁被氧化为QUOTE,试写出该反应的离子方程式2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+.
(3)如图2其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,石墨为阴(填“正”、“负”、“阴”或“阳”)极.在甲装置中滴加几滴酚酞试液,振荡均匀,一段时间后,在甲装置中观察到铜(填“铁”或“铜”)电极附近溶液先变红,该电极的反应式为O2+4e-+2H2O=4OH-.
分析 (1)图1为原电池反应,Fe为负极,发生:Fe-2e-=Fe2+,石墨为正极,发生Cu2++2e-=Cu;根据溶解的铁、析出的铜与电子的关系计算;
(2)用吸管吸出铁片附近溶液即Fe2+的溶液,加入氯水发生2Fe2++Cl2═2Fe3++2Cl-;
(3)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,乙为电解池装置.
解答 解:(1)图1为原电池反应,Fe为负极,发生:Fe-2e-=Fe2-,石墨为正极,发生Cu2++2e-=Cu,总反应式为Fe+Cu2+═Fe2++Cu,一段时间后,两电极质量相差18g,
则Fe+Cu2+═Fe2++Cu 两极质量差△m 转移电子
56g 64g 56g+64g=120g 2mol
18g n
n=0.3mol,
故答案为:Fe+Cu2+═Fe2++Cu;0.3;
(2)用吸管吸出铁片附近溶液即Fe2+的溶液,加入氯水发生2Fe2++Cl2═2Fe3++2Cl-,如果+3价铁被氧化为FeO42-,
发生2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+,
故答案为:2Fe2++Cl2═2Fe3++2Cl-;2Fe3++3Cl2+8H2O═2FeO42-+6Cl-+16H+;
(4)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,铁为负极,铜为正极,正极发生 O2+2H2O+4e-═4OH-,呈碱性,滴加酚酞,溶液变红,则乙装置与铜相连的石墨为阳极,与铁相连的石墨为阴极,
故答案为:阴,铜,O2+4e-+2H2O=4OH-.
点评 本题综合考查原电池和电解池知识,侧重于电化学知识的综合运用的考查,题目难度中等,注意电极反应方程式的书写,为解答该题的关键.

 口算能手系列答案
口算能手系列答案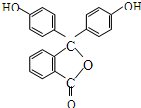
| A. | 酚酞的分子式是C20H12O4 | B. | 分子中的所有碳原子不在同一平面 | ||
| C. | 1mol酚酞最多可能消耗2mol NaOH | D. | 1mol酚酞可与10mol H2加成 |
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
| A. | 36:60 | B. | 60:36 | C. | 1:2 | D. | 1:3 |
| A. | 50mL 1 mol/L NaCl溶液 | B. | 75 mL 2 mol/L CaCl2溶液 | ||
| C. | 50mL 2 mol/L KCl溶液 | D. | 75 mL 1 mol/L AlCl3溶液 |
 如图的实验装置可用于实验室中制取乙炔及成份检验.
如图的实验装置可用于实验室中制取乙炔及成份检验.