题目内容
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是

A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol
D.Y可以是甲酸钠
【答案】C
【解析】
A.铜与硝酸根在酸性环境中反应的离子方程式为3Cu+8H++2NO![]() =3Cu2++2NO↑+4H2O,当HNO3和H2SO4的物质的量之比为2:3时,溶液中H+和NO
=3Cu2++2NO↑+4H2O,当HNO3和H2SO4的物质的量之比为2:3时,溶液中H+和NO![]() 的物质的量之比为8:2,硝酸根恰好可以完全反应,得到全部为硫酸铜,故A正确;
的物质的量之比为8:2,硝酸根恰好可以完全反应,得到全部为硫酸铜,故A正确;
B.途径①、③过程中都会有污染空气的气体产生,途径②中Cu先与氧气反应生成氧化铜,然后再和浓硫酸反应制取硫酸铜,过程中没有污染性气体产生,故B正确;
C.1molCuSO4可以生成0.5molCu2O,若混合气体X中O2为0.75mol,则剩余的氧原子为4mol-0.75mol×2-0.5mol=2mol,恰好与1molS组成1molSO2,但在高温条件下SO2会和O2反应生成SO3,所以混合气体X中不可能只有O2和SO2,故C错误;
D.甲酸钠为HCOONa,含有—CHO结构,可以和新制的氢氧化铜反应生成Cu2O,故D正确;
故答案为C。

 53随堂测系列答案
53随堂测系列答案【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
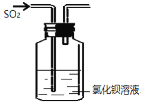
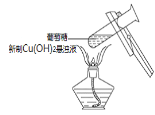
A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
A. AB. BC. C...D. D
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
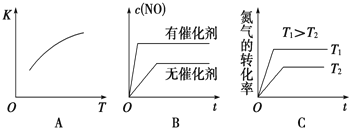
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响。
(2)其中V1=___、T1=__;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=___。
(3)若t1<8,则由此实验可以得出的结论是___;
(4)忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。