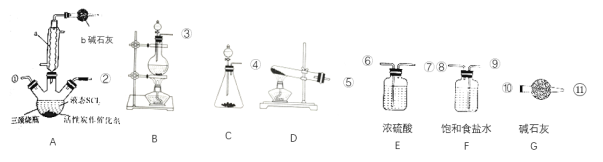
题目内容
【题目】化学上常用燃烧法确定有机物的组成。如图所示装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
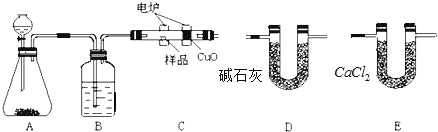
回答下列问题:
(1)若A中装有二氧化锰固体,发生反应的化学方程式为_____。
(2)B装置的作用是_____,燃烧管C中CuO的作用是_____。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E的连接顺序是:C→____→____。
(4)准确称取1.8g 烃的含氧衍生物X 的样品,经充分燃烧后,D管质量增加2.64g,E管质量增加1.08g,则该有机物的实验式(即最简式)是____,实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为_____,1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,X可能的结构简式为_____(任写一种合理结构)。
【答案】2H2O2![]() 2H2O+O2↑ 除去氧气中的水蒸气 使有机物不完全燃烧生成的CO充分氧化生成CO2 E D CH2O C3H6O3 HO-CH2CH2-COOH
2H2O+O2↑ 除去氧气中的水蒸气 使有机物不完全燃烧生成的CO充分氧化生成CO2 E D CH2O C3H6O3 HO-CH2CH2-COOH
【解析】
燃烧法确定有机物的组成,实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.生成O2后必须除杂(主要是除H2O),A用来制取反应所需的氧气、B用来吸收水、C是在电炉加热时用纯氧气氧化管内样品、D用来吸收产生的二氧化碳、E是吸收水;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;利用元素的质量守恒确定物质的化学式。
(1)若A中装有二氧化锰固体,双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是双氧水,发生反应的化学方程式为2H2O2![]() 2H2O+O2↑ 。
2H2O+O2↑ 。
(2)因反应原理是纯氧和有机物反应,B装置的作用是除去氧气中的水蒸气,燃烧管C中CuO的作用是使有机物不完全燃烧生成的CO充分氧化生成CO2。
(3)产生氧气按从左向右流向,D装置中碱石灰能把水和二氧化碳全部吸收,而E装置中氯化钙只吸收水分,为了称取产物水和二氧化碳的质量,故应先吸收水再吸收二氧化碳,故燃烧管C与装置D、E的连接顺序是:C→E→D。
(4)准确称取1.8g 烃的含氧衍生物X 的样品,经充分燃烧后,
D管质量增加2.64g,n(CO2)=2.64g/44g·mol-1=0.06mol,m(C)=0.06mol×12g·mol-1=0.72g;
E管质量增加1.08g,说明生成了1.08g的水,n(H2O)=1.08g/18g·mol-1=0.06mol,m(H)=0.06mol×2×1g·mol-1=0.12g;
从而可推出含氧元素的质量为:1.8g-0.72g-0.12g=0.96g,n(O)=0.96g/16g·mol-1=0.06mol,
N(C):N(H):N(O)=0.06mol:0.12mol:0.06mol=1:2:1,
故该有机物的实验式为CH2O,式量为30;
实验测得X的蒸气密度是同温同压下氢气密度的45倍,该有机物的相对分子质量为:45×2=90,设分子式为 CnH2nOn,30n=90,解得n=3,X分子式为:C3H6O3;
1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,则含一个羟基和一个羧基,该有机物结构简式为:CH3CH(OH)-COOH、HO-CH2CH2-COOH。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响。
(2)其中V1=___、T1=__;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=___。
(3)若t1<8,则由此实验可以得出的结论是___;
(4)忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
【题目】实验室用环己醇(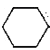 —OH)与85%磷酸在共热条件下制取环已烯(
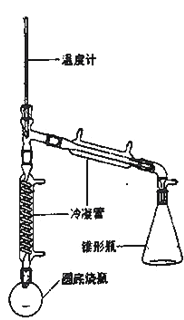
—OH)与85%磷酸在共热条件下制取环已烯(![]() ),制备装置如图所示。
),制备装置如图所示。
实验药品的物理性质:
名称 | 密度(g/mL) | 熔点℃ | 沸点℃ | 溶解性 |
环己醇 | 0.96 | 25.2 | 161 | 微溶于水 |
环己烯 | 0.81 | -103 | 83 | 不溶于水 |
85% H3PO4 | 1.68 | 42.35 | 213(失水) | 易溶于水 |
已知:环己醇能与水形成二元共沸物(含水80%),其沸点为97.8℃
实验原理:
(1)该实验的反应原理与实验室制乙烯相似,请用化学方程式表示______。
(2)该反应有副反应发生(产物为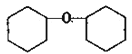 ),反应的方程式为____。
),反应的方程式为____。
II.制备粗产品:
(3)在圆底烧瓶中加入20mL(9.6g)环己醇、10mL 85% H3PO4几粒碎瓷片,用电热包均匀缓慢加热。温度计的温度不应超过90℃,原因是____;85% H3PO4在反应中的作用是____;碎瓷片的作用是_____。
Ⅲ.粗产品提纯
(4)从分液漏斗中分离出来的环己烯还要转移到蒸馏烧瓶中,并加入少量的无水氯化钙进一步蒸馏,此时温度计下端的水银球应插在蒸馏烧瓶的_____位置,温度计显示的温度应为_____。