题目内容
【题目】下列有关化学反应的叙述正确的是( )
A.MnO2和稀盐酸反应制取Cl2
B.过量氨水与SO2反应生成(NH4)2SO3
C.铁在浓硝酸中发生钝化
D.常温下钠与氧气反应生成Na2O2
【答案】B
【解析】
A.浓盐酸能被二氧化锰氧化,发生MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O反应,稀盐酸不能被二氧化锰氧化,故A错误;
MnCl2+Cl2↑+2H2O反应,稀盐酸不能被二氧化锰氧化,故A错误;
B.二氧化硫是酸性氧化物,能和碱反应生成盐和水,所以能和过量氨水反应生成(NH4)2SO3,故B正确;
C.常温下,Fe遇浓HNO3发生钝化现象,加热条件下不会钝化,由于没有注明是常温还是加热条件,故C错误;
D.钠在点燃的条件下与氧气反应生成过氧化钠(Na2O2),常温下生成氧化钠(Na2O),故D错误;
答案为B。

【题目】资料在线:查阅资料可知如表所示数据:
物质 | 乙醇 | 乙酸 | 乙酸乙酯 | 浓硫酸 |
沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
[实验步骤]
某学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4配制浓硫酸、乙醇和乙酸的混合溶液;
②按如图所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;
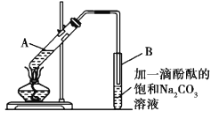
③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)写出制取乙酸乙酯的化学方程式:___________________________。
(2)B试管用饱和碳酸钠做产物的吸收剂,其理由是_____________________。
(3)分离出乙酸乙酯后,为了干燥乙酸乙酯可选用的干燥剂为__________(填字母)。
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
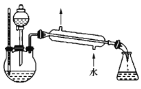
(4)某化学课外小组设计了如图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与上图装置相比,此装置的主要优点有__________________。