题目内容
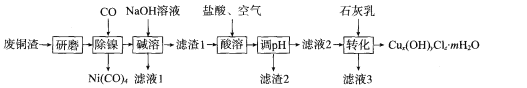
【题目】20℃时,用NaOH调节0.10mol/LH2C2O4溶液的pH,假设不同pH下均有c(H2C2O4)+c(HC2O4—)+c(C2O42-)=0.10mol/L。使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如下图。下列有关分析正确的是

A. 曲线a代表H2C2O4浓度随pH的变化
B. pH从4到6时主要发生的反应离子方程式为2OH-+H2C2O4====2H2O+C2O42-
C. 在曲线a、c交界点有:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
D. 当溶液pH=7时:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4)
【答案】D
【解析】
b曲线代表H2C2O4浓度,a曲线代表HC2O4—浓度,c曲线代表C2O42-浓度。
A、曲线a代表HC2O4—浓度随pH的变化,浓度先变大,再变小,故A错误;
B、pH从4到6时主要发生的反应离子方程式为OH-+HC2O4—=H2O+C2O42-,故B错误;
C、由图中信息可知,在曲线a、c交界点,c(H2C2O4)非常小,c(C2O42-)=c(HC2O4-),溶液呈酸性,但氢离子浓度很小,c(H+)+c(H2C2O4)<c(OH-)+c(C2O42-),故C错误;
D、当溶液pH=7时,溶液呈中性。由图可知,该溶液为Na2C2O4和NaHC2O4的混合溶液,且溶质以Na2C2O4为主,只含很少量的NaHC2O4,C2O42-的一级水解远远大于其二级水解,因此该溶液中相关粒子浓度的大小关系为:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4),故D正确;
故选D。

练习册系列答案
相关题目