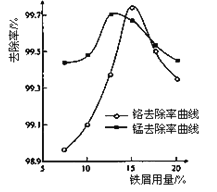
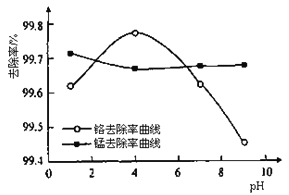
题目内容
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是

A.①代表滴加NaHSO4溶液的变化曲线
B.d点,溶液中大量存在的离子是Na+、SO42–
C.c点,两溶液中含有相同物质的量的OH–
D.d点导电性小于b点,原因可能是发生化学反应导致Na+、SO42-浓度减小
【答案】B
【解析】
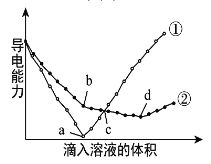
氢氧化钡溶液中逐渐加入硫酸生成硫酸钡沉淀和水,导电性减弱直到为几乎为零,因此①代表硫酸。
A选项,①代表滴硫酸溶液的变化曲线,故A错误;
B选项,d点导电性最低,氢氧根和氢离子反应完,溶液中只剩离子是Na+、SO42–,故B正确;
C选项,c点,①曲线溶液中只有水电离出的氢氧根离子,而另外有一条曲线溶液中氢氧根离子还没有完全反应,故C错误;
D选项,d点导电性小于b点,主要是氢氧根和氢离子反应,故D错误;
综上所述,答案为B。

【题目】环己烯是合成赖氨酸、环己酮、苯酚等的重要原料,也常用作石油萃取剂及高辛烷值汽油稳定剂。
制备环己烯的反应原理:主反应![]() ;副反应
;副反应![]()
制备环己烯的实验装置图如下:(夹持装置及加热装置已省略)
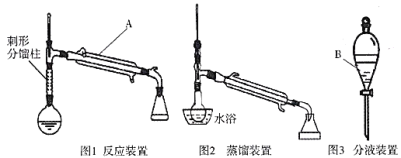
相应的实验流程如下图所示:

相关物质沸点、密度、溶解性如下:
沸点/℃ | 密度/( | 水中溶解性 | |
环己醇 | 161 | 0.962 4 | 可溶于水 |
环己烯 | 83 | 0.811 | 不溶于水 |
85% | 1.69 | 易溶于水 | |
环己烯与水形成的共沸物(含水10%) | 70.8 | ||
环己醇与水形成的共沸物(含水80%) | 97.8 |
回答下列问题:
(1)实验中不用浓硫酸,而用85%![]() 溶液,说明理由________________(写出一条即可)。
溶液,说明理由________________(写出一条即可)。
(2)向粗产物环己烯中加入食盐使水层饱和的目的是_____________;水浴蒸馏前加入无水氯化钙的目的是___________________________.
(3)仪器A、B的名称分别是________________________。
(4)蒸馏提纯时用到水浴加热的方法,其优点是______________(写出两条即可)。
(5)文献资料要求本实验的反应温度应不超过90℃,其原因是_____________________。
(6)